��Ŀ����
����Ŀ���ס��ҡ������ֲ�ͬ�������о�����ͬһ��Ԫ�أ�����֮���ת����ϵ��ͼʾ(���ַ�Ӧ�P����������ȥ)������˵��������ǣ�
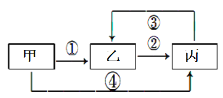
A.����Ϊ��̬�⻯���Ϊ����ɫ���壬�������Ư����
B.����Ϊ���嵥�ʣ���Ϊ���м��Թ��ۼ��ķǼ��Է��ӣ���Ӧ��Ϊ���ȷ�Ӧ
C.����Ϊ����������ҵ�ˮ��Һ�����ԣ����������ǿ��������ǿ�Ӧ
D.����Ϊ�������ʣ���Ӧ��Ϊ�û���Ӧ����������Һ�еμ�KSCN����Һ��ΪѪ��ɫ
���𰸡�C
��������
A. ����Ϊ��̬�⻯��(H2S)����Ϊ����ɫ����(S)���������Ư����(SO2)�������ʶ�������ͷ��ָ������ת����A��ȷ��
B. ����Ϊ���嵥��(O2)����Ϊ���м��Թ��ۼ��ķǼ��Է���(CO2)����Ӧ��(C+CO2)Ϊ���ȷ�Ӧ�������ʶ�������ͷ��ָ������ת����B��ȷ��
C. ����Ϊ����������(Al2O3)���ҵ�ˮ��Һ������(AlCl3)�����[Al(OH)3]������ǿ��������ǿ�Ӧ����Щ���ʶ���ת�������ײ���ת��Ϊ��������C����
D. ����Ϊ��������(Fe)����Ӧ��(Fe+CuCl2)Ϊ�û���Ӧ��������(FeCl3)��Һ�еμ�KSCN����Һ��ΪѪ��ɫ����ͷ��ָ�ĸ����ʼ䶼�ܷ���ת����D��ȷ��
��ѡC��

����Ŀ������±��ش�������������Ϊ�����µ���������
�� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) |
CH3COOH | 1.8��10-5 | H2CO3 | K1=4.4��10-7 K2=4.7��10-11 | H2C2O 4 | K1=5.4��10-2 K2=5.4��10-5 | H2S | K1=1.3��10-7 K2=7.1��10-15 |
HClO | 3��10-8 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO-��HCO3-��CO32-��HC2O4-��ClO-��S2-�н��H+��������������__________��
��2��������0.1 molL-1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����_______�����������
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
��3��0.1 molL-1��H2C2O4��Һ��0.1 molL-1��KOH����Һ�������Ϻ�������Һ�����ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ______________��
��4��pH��ͬ��NaClO��CH3COOK��Һ������Һ�����ʵ���Ũ�ȵĴ�С��ϵ�ǣ�CH3COONa______NaClO������Һ�У�[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)]���������������=������
��5����0.1 molL-1CH3COOH ��Һ�еμ� NaOH ��Һ�� c(CH3COOH): c(CH3COO-)=5 : 9����ʱ��ҺpH=_______________��



