题目内容
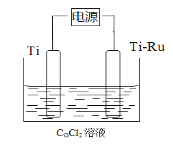
【题目】如图为原电池装置示意图:
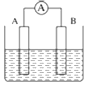
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为______。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式_________。
(2)若A为Pb,B为PbO2,电解质为硫酸溶液,写出B电极反应式:_________;该电池在工作时,A电极的质量将______(填“增重”或“减轻”或“不变”)。若消耗0.1moLH2SO4时,则转移电子数目为______。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,写出A电极反应式:_________;该电池在工作一段时间后,溶液的碱性将______(填“增强”或“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为硫酸溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃烧电池,写出A电极反应式:_________;电池工作时阴离子定向移动到______极(填“正”或“负”)。
(5)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为_________,若将此反应设计成原电池,则负极所用电极材料为______,正极反应式为_________。
【答案】B Al+4OH--3e-=![]() +2H2O PbO2+
+2H2O PbO2+![]() +4H++2e-=PbSO4+2H2O 增重 0.1NA H2+2OH--2e-=2H2O 减弱 CH4-8e-+2H2O═CO2+8H+ 负 2Fe3++Cu=2Fe2++Cu2+ Cu 2Fe3++2e-=2Fe2+
+4H++2e-=PbSO4+2H2O 增重 0.1NA H2+2OH--2e-=2H2O 减弱 CH4-8e-+2H2O═CO2+8H+ 负 2Fe3++Cu=2Fe2++Cu2+ Cu 2Fe3++2e-=2Fe2+
【解析】
两个活动性不同的电极,用导线连接,与电解质溶液接触,并且至少有一个电极材料能与电解质发生氧化还原反应(燃料电池除外),才可形成原电池。若两个电极材料都能与电解质发生持续的氧化还原反应,则相对活泼的电极为负极,若只有一个电极材料能与电解质发生氧化还原反应,则此电极为负极。
(1)插入浓硝酸中的一组,由于铝片会发生钝化,与浓硝酸的反应不能持续进行,而铜片能与浓硝酸在常温下持续反应,所以铜片为负极;插入烧碱溶液中的一组,只有铝片能与烧碱溶液发生反应,所以铝片为负极,因此,在这两个原电池中,负极分别为铜片、铝片,故选B。插入烧碱溶液中,形成原电池的负极为铝片,失电子产物与OH-发生反应,最终生成![]() 和水,电极反应式为Al+4OH--3e-=
和水,电极反应式为Al+4OH--3e-=![]() +2H2O。答案为:B;Al+4OH--3e-=
+2H2O。答案为:B;Al+4OH--3e-=![]() +2H2O;
+2H2O;
(2)若A为Pb,B为PbO2,电解质为硫酸溶液,则Pb为负极,PbO2为正极,B电极中,PbO2得电子产物与![]() 、H+反应生成PbSO4和H2O,电极反应式为:PbO2+
、H+反应生成PbSO4和H2O,电极反应式为:PbO2+![]() +4H++2e-=PbSO4+2H2O;该电池在工作时,A电极中的Pb失电子产物与
+4H++2e-=PbSO4+2H2O;该电池在工作时,A电极中的Pb失电子产物与![]() 反应生成PbSO4,A极质量将增重;总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,若消耗0.1moLH2SO4时,则转移电子数目为0.1NA。答案为:增重;0.1NA;
反应生成PbSO4,A极质量将增重;总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,若消耗0.1moLH2SO4时,则转移电子数目为0.1NA。答案为:增重;0.1NA;
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,A电极为负极,B电极为正极,在A电极,H2失电子产物与OH-反应生成H2O,电极反应式为:H2+2OH--2e-=2H2O;B电极反应式为:O2+4e-+2H2O=4OH-,总反应为:2H2+O2=2H2O,该电池在工作一段时间后,虽然n(OH-)不变,但溶液体积增大,c(OH-)减小,所以溶液的碱性将减弱。答案为:H2+2OH--2e-=2H2O;减弱;
(4)若A、B均为铂片,电解质为硫酸溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,A电极为负极,CH4失电子产物与水反应生成CO2和H+,A电极反应式为:CH4-8e-+2H2O═CO2+8H+;电池工作时阴离子定向移动负极。答案为:CH4-8e-+2H2O═CO2+8H+;负;
(5)FeCl3溶液常用于腐蚀印刷电路铜板时,Fe3+与Cu发生反应生成Fe2+和Cu2+,其反应过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+,若将此反应设计成原电池,负极失电子,则所用电极材料为Cu,正极Fe3+得电子生成Fe2+,电极反应式为2Fe3++2e-=2Fe2+。答案为:2Fe3++Cu=2Fe2++Cu2+;Cu;2Fe3++2e-=2Fe2+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案