题目内容
【题目】依据Cd(Hg)+Hg2SO4=3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图。下列有关该电池的说法正确的是
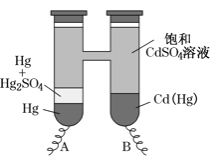
A.电池工作时Cd2+向电极B移动
B.反应中每生成amolHg转移2amol电子
C.电极B上发生的反应:Cd(Hg)-4e-=Hg2++ Cd2+
D.电极A上发生的反应:Hg2SO4+2e-=2Hg+ SO42-
【答案】D
【解析】
根据反应原理分析,Cd(Hg)为合金材料,金属的化合价均为0,其中的Cd失去电子,作负极,发生的电极反应为Cd(Hg)-2e-=Cd2++Hg;而Hg2SO4得到电子,作正极,电极反应为Hg2SO4+2e-=2Hg+SO42-。
A.原电池中,阳离子向正极移动,A为正极,则Cd2+向电极A移动,A错误;
B.根据反应原理,每生成3molHg,转移2mol电子,则每生成amolHg转移![]() mol电子,B错误;
mol电子,B错误;
C.Cd(Hg)中Hg的化合价没有变化,仍为0价,则电极反应为Cd(Hg)-2e-=Cd2++Hg,C错误;
D.根据反应原理,在A极上,Hg2SO4得到电子生成Hg单质,电极方程式为Hg2SO4+2e-=2Hg+ SO42-,D正确。
答案选D。

【题目】下表列出9种元素在周期表中的位置,请按要求回答问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)⑦的简单离子的结构示意图是______。表中标注的元素的最高价氧化物对应的水化物中碱性最强的碱是_____(填写化学式)。③、④、⑨三种元素按原子半径由大到小的顺序排列为 ______ (用元素符号表示)。
(2)元素②的气态氢化物的电子式是_______。由3个元素②的原子组成带一个单位负电荷的阴离子中含有_______个电子。写出该元素氢化物与其最高价氧化对应水化物反应的离子方程
式_____________。
(3)⑦、⑧两元素简单离子还原性强弱为______(填离子符号)。
(4)某研究性学习小组设计了一组实验验证元周期律。
Ⅰ:甲同学在A、B两只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的③、⑨元素单质,观察现象。甲同学设计实验的目的是_____。写出元素⑨的单质与水反应的化学方程式为________。
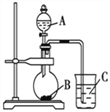
Ⅱ:乙同学设计如图装置以验证①、⑥、⑦元素的非金属性强弱。为了达到实验目的,仪器A、B、C分别选择的药品为A______、B______、C______;烧杯中发生反应的离子方程式为______________。