题目内容
能大量共存的一组离子是
| A.K+、Ca2+、Cl-、NO3- | B.H+、Na+、Fe2+、MnO4- |
| C.Na+、H+、SO42-、ClO- | D.K+、AlO2-、Cl-、HCO3- |
A
解析试题分析:A、离子之间均不反应,能够大量共存,正确;B、Fe2+ 具有还原性与酸性条件下 发生氧化还原反应,错误;C、H+ 与ClO- 生成次氯酸分子不能大量共存,错误;D、AlO2- 与HCO3- 发生双水解,生成氢氧化铝沉淀和二氧化碳气体,错误。
发生氧化还原反应,错误;C、H+ 与ClO- 生成次氯酸分子不能大量共存,错误;D、AlO2- 与HCO3- 发生双水解,生成氢氧化铝沉淀和二氧化碳气体,错误。
考点:离子反应及共存问题的判断。

练习册系列答案
相关题目
下列离子方程式与所述事实相符且正确的是
| A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2+ +2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-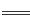 3Fe3++NO↑+3H2O 3Fe3++NO↑+3H2O |
| C.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4 Fe2++2 Br-+3Cl2=4Fe3++6Cl-+Br2 |
D.以铜为电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
下列反应的离子方程式,正确的是( )
A.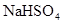 溶液与 溶液与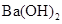 溶液混合: 溶液混合: ↓ ↓ |
B.醋酸除水垢: ↑+ ↑+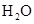 |
C.漂白粉溶液中通入过量的 ↓+ ↓+ |
D.少量金属钠放入冷水中: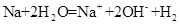 ↑ ↑ |
下列各组离子,能在强酸溶液中大量共存,并且溶液呈无色的是
| A.Na+、Ca2+、Cl-、HCO3— | B.K+、Na+、NO3-、MnO4- |
| C.Mg2+、Na+、SO42-、Cl- | D.NH4+、Al 3+、NO3-、OH- |
下列离子反应方程式正确的是
| A.金属钠投入蒸馏水2 Na+2H2O=2 Na++2OH- +H2↑ |
| B.向亚硫酸钠溶液中加入足量硝酸SO3 2- +2 H+=SO2↑+ H2O |
| C.用浓盐酸与MnO2反应制取少量氯气MnO2+4H++2C1- = Mn2+ + 2H2O+Cl2↑ |
| D.硫酸亚铁溶液中加入酸化的双氧水Fe2++2H++H2O2 = Fe3++2H2O |
下列化学方程式中,不能用离子方程式H++OH-=H2O表示的是
| A.2NaOH+H2SO4=Na2SO4+2H2O | B.Ba(OH)2+2HCl=BaCl2+2H2O |
| C.KOH+HCl=KCl+H2O | D.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O |
常温下,在c(H+)/c(OH?)=1×1012的溶液中,下列各组离子能大量共存的是
| A.Fe2+、Mg2+、NO3?、SO42? | B.Fe3+、Na+、Cl?、SCN? |
| C.NH4+、Al3+、NO3?、Cl? | D.Ca2+、K+、Cl?、HCO3? |
下表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与稀硝酸反应:2Fe3O4+18H+ =6Fe3++H2↑+8H2O | 正确 |
| B | 向碳酸镁中加入稀盐酸: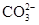 +2H+ =CO2↑+H2O +2H+ =CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++ 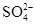 =" " BaSO4↓ =" " BaSO4↓ | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1∶2 |
下表所列各组第Ⅰ栏中的化学反应与第Ⅱ栏中的化学反应,都可以用第Ⅲ栏中的离子方程式表示的是 ( )。
| 选项 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中投入铝片 | 往过量NaOH溶液中投入铝片 | 2Al+2OH-+ 2H2O===2AlO2— +3H2↑ |
| B | 往Fe2(SO4)3溶液中滴入NaOH溶液 | 往Fe2(SO4)3溶液中滴入Ba(OH)2溶液 | Fe3++3OH-===Fe(OH)3↓ |
| C | 往NaHCO3溶液中滴入Ca(OH)2溶液 | 往NaHCO3溶液中滴入NaOH溶液 | OH-+HCO3—====CO32—+H2O |
| D | 往NaOH溶液中通入过量CO2气体 | 往NaOH溶液中通入少量CO2气体 | CO2+OH-===HCO3— |