题目内容
下列反应的离子方程式,正确的是( )
A.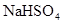 溶液与 溶液与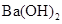 溶液混合: 溶液混合: ↓ ↓ |
B.醋酸除水垢: ↑+ ↑+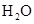 |
C.漂白粉溶液中通入过量的 ↓+ ↓+ |
D.少量金属钠放入冷水中: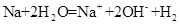 ↑ ↑ |
B
解析试题分析:A、NaHSO4溶液与Ba(OH)2溶液混合,除了生成BaSO4沉淀外,还生成H2O,错误;B、CH3COOH与CaCO3反应生成(CH3COO)2Ca、CO2、H2O,(CH3COO)2Ca为强电解质,拆为离子可得离子方程式,正确;C、过量的CO2反应生成HCO3?,错误;D、没有配平,电荷不守恒,错误。
考点:本题考查离子方程式的书写。

练习册系列答案
相关题目
能正确表示下列化学反应的离子方程式是
| A.碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
B.工业制备氯气:2NaCl+2H2O 2Na+ +2OH-+H2↑+Cl2↑ 2Na+ +2OH-+H2↑+Cl2↑ |
| C.金属钠与足量盐酸反应:2Na + 2H+=2Na+ + H2↑ |
| D.硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
能大量共存的一组离子是
| A.K+、Ca2+、Cl-、NO3- | B.H+、Na+、Fe2+、MnO4- |
| C.Na+、H+、SO42-、ClO- | D.K+、AlO2-、Cl-、HCO3- |
在c(H+)/c(OH-)=10―12的水溶液中,能大量共存的离子组是
| A.Na+、K+、NO3-、CH3COO- | B.Fe3+、K+、SCN-、Cl- |
| C.K+、Al3+、Cl-、SO42- | D.Na+、Ba2+、I-、HCO3- |
下列物质中属于电解质的是
| A.NH3 | B.(NH4)2SO4 | C.Cl2 | D.NaCl溶液 |
某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g。
下列说法中正确的是:
| A.该溶液中一定不含Ba2+ 、Mg2+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| C.该溶液是否有K+ 需做焰色反应(透过蓝色钴玻璃片) |
| D.可能含有Cl- |
类推是化学研究中常用的一种思维方式,下列有关离子反应方程式的类推正确的是( )。
| | 已知 | 类推 |
| A | 向次氯酸钙溶液中通CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向次氯酸钙溶液中通SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B | 用惰性电极电解硫酸铜溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ | 用铜电极电解硫酸铜溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| C | 稀硫酸与Ba(OH)2溶液反应,pH=7时,2H++SO42—+Ba2++2OH-=BaSO4↓+2H2O | 硫酸氢钠溶液与Ba(OH)2溶液反应,pH=7时,2H++SO42—+Ba2++2OH-=BaSO4↓+2H2O |
| D | Ba(OH)2溶液逐滴滴入硫酸铝钾溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42—=2BaSO4↓+AlO2—+2H2O | Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42—=2BaSO4↓+AlO2—+2H2O |
下列解释实验现象的反应方程式正确的是( )
| A.在CH3COONa溶液中,滴加酚酞溶液变红: CH3COO-+H2O  CH3COOH+OH- CH3COOH+OH- |
| B.在H2O2溶液中,滴加FeCl3溶液产生气泡: 2H2O2+2Cl-  2H2O+O2↑+Cl2↑ 2H2O+O2↑+Cl2↑ |
| C.将相互接触的铜片和锌片置于稀硫酸中,铜片表面有气泡产生: Cu+2H+  Cu2++H2↑ Cu2++H2↑ |
| D.向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑色: |
 CuS(s)+2OH-
CuS(s)+2OH- 下列离子方程式正确的是(双选) ( )。
| A.氯化铁溶液中加入铜粉:2Fe3++Cu===2Fe2++Cu2+ |
| B.向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+===Fe2++2H2O |
| C.硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42—===BaSO4↓ |
| D.向硫酸氢钠溶液中滴加Ba(OH)2溶液至中性:2H++SO42—+Ba2++2OH-===BaSO4↓+2H2O |