题目内容
下列离子反应方程式正确的是
| A.金属钠投入蒸馏水2 Na+2H2O=2 Na++2OH- +H2↑ |
| B.向亚硫酸钠溶液中加入足量硝酸SO3 2- +2 H+=SO2↑+ H2O |
| C.用浓盐酸与MnO2反应制取少量氯气MnO2+4H++2C1- = Mn2+ + 2H2O+Cl2↑ |
| D.硫酸亚铁溶液中加入酸化的双氧水Fe2++2H++H2O2 = Fe3++2H2O |
A
解析试题分析:A. 反应原理符合客观事实,拆写也符合离子方程式的要求。正确。B. 硝酸有强的氧化性,而亚硫酸有还原性,二者发生氧化还原反应,反应的离子方程式为:3SO3 2- +2H+ +2NO3- =3SO42-+2NO↑+ H2O.错误。C. 用浓盐酸与MnO2反应制取少量氯气,反应条件是加热,反应的两种方程式为:MnO2+ 4H++2C1-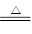 Mn2+ + 2H2O+Cl2↑。错误。D.电子不守恒,电荷不守恒。正确的应该为:2Fe2++2H++H2O2 =2Fe3++2H2O。错误。
Mn2+ + 2H2O+Cl2↑。错误。D.电子不守恒,电荷不守恒。正确的应该为:2Fe2++2H++H2O2 =2Fe3++2H2O。错误。
考点:考查离子反应方程式书写的知识。

练习册系列答案
相关题目
下列示意图与对应的反应情况正确的是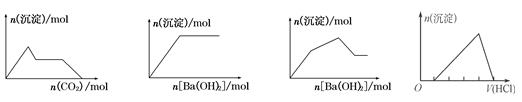
A B C D
| A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2 |
| B.NaHSO4溶液中逐滴加入Ba(OH)2溶液 |
| C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 |
| D.向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸 |
能大量共存的一组离子是
| A.K+、Ca2+、Cl-、NO3- | B.H+、Na+、Fe2+、MnO4- |
| C.Na+、H+、SO42-、ClO- | D.K+、AlO2-、Cl-、HCO3- |
在c(H+)/c(OH-)=10―12的水溶液中,能大量共存的离子组是
| A.Na+、K+、NO3-、CH3COO- | B.Fe3+、K+、SCN-、Cl- |
| C.K+、Al3+、Cl-、SO42- | D.Na+、Ba2+、I-、HCO3- |
下列各组离子在指定条件下,能够大量共存的是( )
| A.滴加KSCN溶液后变成血红色的溶液中:K+、SO42―、Mg2+、H+ |
| B.由水电离出的c(H+)=1×10-11mol/L的无色溶液中:Al3+、Cu2+、NO3―、SO42― |
| C.能使淀粉KI试纸变蓝的无色溶液中:Na+、S2―、K+、Br― |
| D.能使蓝色石蕊试纸变红的溶液中:K+、Na+、AlO2―、HCO3― |
下列物质中属于电解质的是
| A.NH3 | B.(NH4)2SO4 | C.Cl2 | D.NaCl溶液 |
下列离子方程式正确的是
A.用惰性电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
B.苯酚与碳酸钠溶液: + CO32—→ + CO32—→ + H2CO3 + H2CO3 |
| C.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++ 3SO42-+ 3Ba2++6OH-→3BaSO4↓+ 2Fe(OH)3↓ |
| D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3→2FeO42-+3Cl-+ H2O+4H+ |
下列离子方程式正确的是
| A.用Fe除去FeCl2溶液中的少量的FeCl3杂质:Fe+Fe3+=2Fe2+ |
B.实验室制取NO2:Cu+4H++2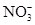 =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
C.硫酸溶液与氢氧化钡溶液混合:H++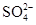 +Ba2++OH-=BaSO4↓+H2O +Ba2++OH-=BaSO4↓+H2O |
D.向氯化铝溶液通足量氨气:Al3++4NH3+4H2O=4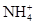 +[Al(OH)4]- +[Al(OH)4]- |
下列解释实验现象的反应方程式正确的是( )
| A.在CH3COONa溶液中,滴加酚酞溶液变红: CH3COO-+H2O  CH3COOH+OH- CH3COOH+OH- |
| B.在H2O2溶液中,滴加FeCl3溶液产生气泡: 2H2O2+2Cl-  2H2O+O2↑+Cl2↑ 2H2O+O2↑+Cl2↑ |
| C.将相互接触的铜片和锌片置于稀硫酸中,铜片表面有气泡产生: Cu+2H+  Cu2++H2↑ Cu2++H2↑ |
| D.向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑色: |
 CuS(s)+2OH-
CuS(s)+2OH-