题目内容
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持及尾气处理等装置已略)。

Ⅰ.配制银氨溶液
(1)关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到三颈烧瓶中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出三颈烧瓶中生成银氨溶液的化学方程式________________________。
II.测定室内空气中甲醛含量
(2)装置中毛细管的作用是________________________________________________。
(3)用热水浴加热三颈烧瓶,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是_________________________________________。共计进行上述操作十次。
(4)待甲醛充分被银氨溶液氧化为碳酸盐后,测得三颈瓶中共生成Ag 2.16mg。则空气中甲醛的含量为___________mg·L-1(空气中其它物质不与银氨溶液反应)。
【答案】AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O或AgNO3+NH3·H2O=AgOH↓+NH4NO3、AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O 减小气体通入速率,使空气中甲醛气体被完全吸收 打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2 0.015或1.5×10—2
【解析】
(1)A中饱和食盐水和氮化镁反应制取氨气,氨气通入硝酸银溶液中制备银氨溶液,三颈烧瓶中生成银氨溶液的化学方程式为AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O;
(2)装置中毛细管的作用是减小气体通入速率,使空气中甲醛气体被完全吸收;
(3)用热水浴加热三颈烧瓶,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2;
(4)甲醛和银氨溶液反应生成银和碳酸盐,根据甲醛被氧化为碳酸盐,氢氧化二氨合银被还原为单质银,甲醛中碳元素化合价由0价→+4价,银由+1价→0价,生成Ag 2.16mg,
根据电子守恒规律:设消耗甲醛的物质的量为x,则4x=![]() =2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mg·L-1。
=2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mg·L-1。
(1)A中饱和食盐水和氮化镁反应制取氨气,氨气通入硝酸银溶液中制备银氨溶液,三颈烧瓶中生成银氨溶液的化学方程式为AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O;
故答案为:AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O;
(2)装置中毛细管的作用是减小气体通入速率,使空气中甲醛气体被完全吸收,
故答案为:减小气体通入速率,使空气中甲醛气体被完全吸收;
(3)用热水浴加热三颈烧瓶,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2,
故答案为:打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2;
(4)甲醛和银氨溶液反应生成银和碳酸盐,根据甲醛被氧化为碳酸盐,氢氧化二氨合银被还原为单质银,甲醛中碳元素化合价由0价→+4价,银由+1价→0价,生成Ag 2.16mg,
根据电子守恒规律:设消耗甲醛的物质的量为x,则4x=![]() =2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mg·L-1。
=2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mg·L-1。
故答案为:0.015。

【题目】A、B、C、D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是 ( )
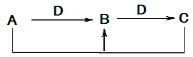
选项 | 假设 | 结论 |
A | A为NaOH溶液 | D可能是CO2 |
B | B为CO | C可能是CO2 |
C | C为FeCl2 ,D为Fe | A可能是盐酸 |
D | C为SO2 | A可能是H2S |
A. A B. B C. C D. D