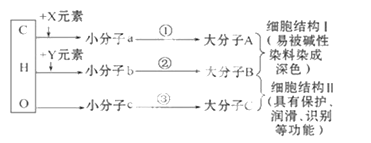
题目内容
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为___________。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_____________,电负性由大到小的顺序为__________________________________________________。
(3)H2O 与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是_________________________________________。
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为_____________,所含共价键的类型为_____________,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为________________________________________。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。

①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_____________。
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为_____________(列出计算式即可,用NA表示阿伏加德罗常数的数值)g/cm3。
【答案】4s24p3 Cl>P>S Cl>S>P 氧的电负性大且原子半径小,H2O分子间及与H+可形成氢键,而硫的电负性较小且原子半径大,几乎不能形成氢键 sp σ键和π键 ![]() 原子晶体 (1/4,1/4,3/4)
原子晶体 (1/4,1/4,3/4) ![]()
【解析】
(1)砷的核电荷数为33,基态砷原子的核外电子排布式为[Ar]4s24p3,价电子排布式为4s24p3;
(2)P、S、Cl均为第三周期主族元素,它们的第一电离能呈增大趋势,但P原子的3p轨道为半充满结构相对稳定,三种原子的第一电离能由大到小的顺序为Cl>P>S,非金属性越强,电负性越大,三种元素的电负性由大到小的顺序为 Cl>S>P;
(3) 氧的电负性大且原子半径小,H2O分子间及与H+可形成氢键,而硫的电负性较小且原子半径大,几乎不能形成氢键故H2O可以形成H9O4+以或H3O+,而H2S几乎不能形成类似的H9S4+或H3S+;
(4)COS分子的结构式为O=C=S,含有σ键和π键,COS分子中C原子形成2个σ键,孤对电子数为![]() =0,则为sp杂化;N2O分子中O只与一个N相连,则结构式为N=N=O;
=0,则为sp杂化;N2O分子中O只与一个N相连,则结构式为N=N=O;
(5) ①AlP晶体熔点为2000℃ ,且晶胞中形成的是立体网状结构,应为原子晶体;
② A、B点的原子坐标分别为(0、0、0)、(1、![]() 、
、![]() )可知晶胞边长为1,由此可推知C点的原子坐标为(
)可知晶胞边长为1,由此可推知C点的原子坐标为(![]() ,
,![]() ,
,![]() );
);
③根据均摊法,晶胞中含有P原子数为8×![]() +6×
+6×![]() =4,Al原子数也为4,则1mol晶胞的质量为4×(27+31)g=4×58g,根据
=4,Al原子数也为4,则1mol晶胞的质量为4×(27+31)g=4×58g,根据![]() =
=![]() 计算密度。
计算密度。
(1)砷的核电荷数为33,基态砷原子的核外电子排布式为[Ar]4s24p3,价电子排布式为4s24p3;
故答案为:4s24p3;
(2)P、S、Cl均为第三周期主族元素,它们的第一电离能呈增大趋势,但P原子的3p轨道为半充满结构相对稳定,三种原子的第一电离能由大到小的顺序为Cl>P>S,非金属性越强,电负性越大,三种元素的电负性由大到小的顺序为 Cl>S>P,
故答案为:Cl>P>S ;Cl>S>P;
(3)氧的电负性大且原子半径小,H2O分子间及与H+可形成氢键,而硫的电负性较小且原子半径大,几乎不能形成氢键故H2O可以形成H9O4+以或H3O+,而H2S几乎不能形成类似的H9S4+或H3S+;
故答案为:氧的电负性大且原子半径小,H2O分子间及与H+可形成氢键,而硫的电负性较小且原子半径大,几乎不能形成氢键;
(4)COS分子的结构式为O=C=S,含有σ键和π键,COS分子中C原子形成2个σ键,孤对电子数为![]() =0,则为sp杂化;N2O分子中O只与一个N相连,则结构式为N=N=O,电子式为
=0,则为sp杂化;N2O分子中O只与一个N相连,则结构式为N=N=O,电子式为![]() ,
,
故答案为:sp ;σ键和π键;![]() ;
;
(5) ①AlP晶体熔点为2000℃ ,且晶胞中形成的是立体网状结构,应为原子晶体;
② A、B点的原子坐标分别为(0、0、0)、(1、![]() 、
、![]() )可知晶胞边长为1,由此可推知C点的原子坐标为(
)可知晶胞边长为1,由此可推知C点的原子坐标为(![]() ,
,![]() ,
,![]() );
);
③晶胞中含有P原子数为8×![]() +6×
+6×![]() =4,Al原子数也为4,则1mol晶胞的质量为4×(27+31)g=4×58g,晶胞的体积为(5.4635×10-8)3cm3,晶胞密度为
=4,Al原子数也为4,则1mol晶胞的质量为4×(27+31)g=4×58g,晶胞的体积为(5.4635×10-8)3cm3,晶胞密度为![]() g/cm3。
g/cm3。
故答案为:原子晶体;(![]() ,
,![]() ,
,![]() );
); ![]() 。
。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0
N2(g)+2CO2(g) ΔH<0
①一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C.N2和CO2的体积比保持不变 D.v正(CO)=2v逆(N2)
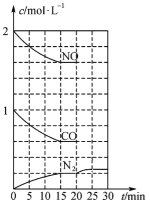
②20min时,若改变反应条件,导致N2浓度发生如下图所示的变化,则改变的条件可能是______(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2的量 D.缩小容器体积
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g) +NO(g),正反应速率随时间变化如图所示。由图可得出的正确结论是__(填字母)
SO3(g) +NO(g),正反应速率随时间变化如图所示。由图可得出的正确结论是__(填字母)
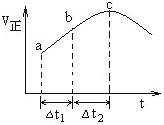
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图回答问题。
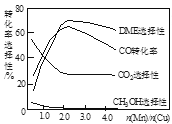
催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g)ΔH=-92.9kJ/mol,300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g)ΔH=-92.9kJ/mol,300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平衡 时的 数据 | CH3OH浓度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收c kJ | ||
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法中正确的是____________
A.2c1>c3 B.a+b=92.9 C.2p2<p3 D.α1+α3<1