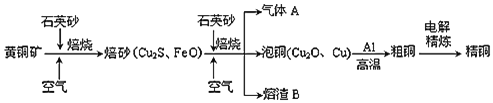
题目内容
【题目】实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:

(1)反应需在50℃~60℃的温度下进行,图中给反应物加热的方法是________,其优点是________和________;
(2)在配制混合酸时应将__________加入到________中去;
(3)该反应的化学方程式是___________________________________________;
(4)由于装置的缺陷,该实验可能会导致的不良后果是________。
【答案】水浴加热 便于控制温度 受热均匀 浓硫酸 浓硝酸 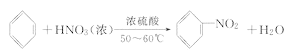 苯、浓硝酸等挥发到空气中,造成污染
苯、浓硝酸等挥发到空气中,造成污染
【解析】
(1)图中给反应物加热的方法是水浴加热,水浴加热便于控制温度,受热均匀;
(2)配制混合酸时应将浓硫酸加入浓硝酸中,并不断振荡,以防止溅出伤人;
(3)苯与浓硝酸在浓硫酸、加入条件下发生取代反应生成硝基苯与水;
(4)由于苯和硝酸都是易挥发、有毒的物质,设计实验时应考虑它们可能产生的污染和由挥发导致的利用率降低。
(1)图中给反应物加热的方法是水溶加热,水域加热便于控制温度,受热均匀,
故答案为:水浴加热;便于控制温度、受热均匀。
(2)配制混合酸时应将密度大的浓硫酸加入到密度小的浓硝酸中去,配制混合酸时应将浓硫酸加入浓硝酸中,并不断振荡,以防止溅出伤人,
故答案为:浓硫酸、浓硝酸;
(3)苯与浓硝酸在浓硫酸、加入条件下发生取代反应生成硝基苯与水,反应方程式为:![]() ,
,
故答案为:![]() 。
。
(4)由于苯和硝酸都是易挥发、有毒的物质,应考虑它们可能产生的污染和由挥发导致的利用率降低,装置缺少冷凝回流装置,
故答案为:苯、浓硝酸等挥发到空气中,造成污染。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】我国规定饮用水质量标准必须符合下表所示要求:
项目 | pH | Ca2+、Mg2+总浓度 | 细菌个数 |
相关值 | 6.5~8.5 | <0.0045mol·L-1 | <100个·mL-1 |
下图是源水处理成自来水的工艺流程示意图。

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,在一级沉降池中所得沉淀的主要成分为 _____ 和_______ (化学式)。
(2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀。凝聚剂除去悬浮固体颗粒的过程______________(填写编号)。
①只是物理过程; ②只是化学过程; ③是物理和化学过程。
(3)Cl2的作用是______ ,这种作用是基于Cl2和水反应的产物具有 _______ 性。
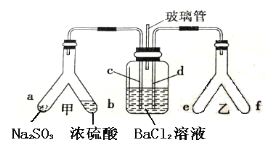
【题目】某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。

(1)Na2O2中含有的化学键类型:__________;请写出a中反应的化学方程式______。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2+ H2O =" NaOH" + H2O22H2O2= 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中,____________,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
①_____________________;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
实验 | 操作 | 现象 | 结论 |
1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ①___________ |
2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |
|
3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12…… | ②_____________________________…… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
(5)某同学按取(4)中述实验2褪色后的溶液,加水稀释至pH=12,没有观察到溶液变红。该同学推测实验2加盐酸后溶液变红还可能与温度有关,请写出理由:___________。