题目内容
下列有关热化学方程式的叙述正确的是 ( )
| A.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为-285.8 kJ/mol |
| B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2 |
A
解析试题分析:燃烧热是指1mol可燃物完全燃烧生成稳定化合物时放出的热量,A正确;物质的能量越低,其稳定性越强,石墨吸收能量变为金刚石,故石墨的能量更低,B错误;稀醋酸溶于水发生电离,吸热反应,故与氢氧化钠反应放出的能量应小于57.4 kJ,C错误;碳单质完全燃烧,放出的能量更多,故焓变(放热反应为负值)更小,D错误。
考点:热化学方程式
点评:热化学方程式是历年高考必考知识点,考生在备考过程中应注意掌握以下几点:1、运用盖斯定律计算某个反应的反应热。2、根据题意,正确书写某个反应的热化学方程式。3、利用热化学方程式进行简单的计算。

练习册系列答案
相关题目
下列说法正确的是
A.右图可表示水分解过程中的能量变化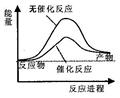 |
| B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol, |

且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ
关于热化学方程式:2H2(g)+02(g)=2H20(1)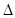 H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
| A.2mol H2完全燃烧生成液态水放出571.6 kJ的热 |
| B.1mol H2完全燃烧生成液态水时放出285.8kJ的热 |
| C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热 |
D.上述热化学方程式可表示为H2(g)+1/2 O2(g)=H20(1),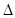 H=-285.8 kJ·mol-1 H=-285.8 kJ·mol-1 |
下列说法中不正确的是
| A.与煤油、柴油相比较,天然气是一种比较清洁的化石燃料 |
| B.乙醇是一种可再生能源,作为燃料的优点的是完全燃烧的产物不污染环境 |
| C.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量 |
| D.煤的气化和液化不仅可以获得洁净燃料,而且再燃烧会放出更多的热量 |
下列有关说法不正确的是:
A.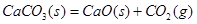 室温下不能自发进行,说明该反应的 室温下不能自发进行,说明该反应的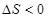 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.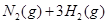  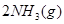 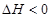 ,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大 ,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大 |
| D.水的离子积常数KW随着温度的升高而增大,说明水的电离是吸热过程 |

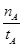 mol·L-1·min-1
mol·L-1·min-1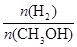 增大
增大 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
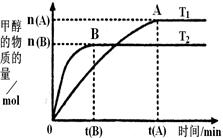
 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。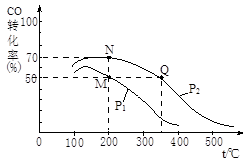
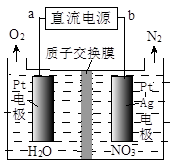
 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性