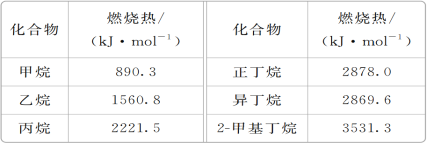
题目内容
【题目】按下图装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为_____________B池为____________
(2)铜极为__________极,电极反应式为______________________________
石墨棒C1为______极,电极反应式为_______________________________,检验该产物的简单方法是____________________________________________________
石墨棒C2附近发生的实验现象为____________________________________
(3)当C2极析出224mL气体(标准状态)时,锌的质量减少了______________g。CuSO4溶液的质量增加了_________________________g 。
【答案】 原电池 电解池 正 Cu2++2e-=Cu 阳 2Cl--2e-=Cl2↑ 湿润的淀粉KI试纸变蓝 气泡,溶液变红 0.65g 0.01g
【解析】(1)有外加电源的是电解池,没有外加电源的是原电池或者根据原电池和电解池的构成条件来回答;(2)原电池中活泼金属做负极,发生失电子的氧化反应;(3)和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;(4)根据电子守恒定律来计算回答。
(1)由图示可知A池是锌铜原电池,做为电源电解B池,B是电解池,连接Zn负极的C2电极为阴极,连接Cu正极的C1电极为阳极。故答案为:原电池 ;电解池;
(2)A池为原电池:Zn + Cu2+==Zn2++ Cu
负极:Zn-2e-=Zn2+正极:Cu2++2e-=Cu
B池为电解池:2KCl+2H2O =2KOH+H2↑+Cl2↑
阴极:2H++2e-=H2↑;阳极:2Cl—+2e—= Cl2↑
阳极产生氯气,检验氯气的简易方法是:湿润的淀粉KI试纸变蓝;在阴极由于氢离子的放电,导致溶液呈碱性,酚酞呈红色。故答案为:气泡,溶液变红;
(3)224ml气体是氢气,物质的量是0.01mol,则转移0.02mol电子,所以根据电子的得失守恒可知,消耗锌的物质的量是0.02mol÷2=0.01mol,质量是0.65g,即锌的质量减少0.65g。原电池中每进入1 molZn而析出1 molCu,故溶液的质量增加65g-64g =1 g
H2 ~ 2e- ~△m
1mol 1 g
0.01mol 0.01g
因此,本题答案为:0.65g ; 0.01g;

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】下表为元素周期表的一部分,参照元素①~在表中的位置,请回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素,化学性质最稳定的是________,金属性最强的是__________,非金属性最强的是_______(写编号);最高价氧化物的水化物的酸性最强的是(写化学式)___________。
(2)④、⑩的气态氢化物中的稳定性强些的是_______。(填化学式)
(3)④、⑥、⑦、⑩元素形成的离子,离子半径的大小顺序是 ____________(填化学式)
(4)写出一种由①④组成且含有非极性键的物质的电子式_____________。
(5)实验室制取气体的离子方程式为_____________________________
(6)利用较强酸能制出较弱酸的原理,写出一个能证明②和⑧非金属性强弱的一个常见反应的化学方程式_______________。