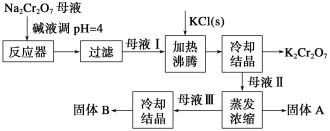
题目内容
【题目】已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素;W原子的质子数等于Y、Z原子最外层电子数之和;Y与X形成的分子中有3个共价键,Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)由上述元素组成的4核10电子的离子的电子式_____________;
(2)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式 ________________;
(3)由X、Y、Z所形成的常见离子化合物是____________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______________;X与W形成的化合物与水反应时,离子方程式为________________;
(4)用电子式表示W与Z形成W2Z化合物的过程:__________________。
【答案】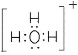 2H2O2
2H2O2![]() 2H2O+O2↑ NH4NO3 NH4++OH-
2H2O+O2↑ NH4NO3 NH4++OH-![]() NH3↑+H2O NaH + H2O = Na+ + OH- + H2↑
NH3↑+H2O NaH + H2O = Na+ + OH- + H2↑ ![]()
【解析】
X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大,则X为H元素;Z原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y、Z为同周期的相邻元素,则Y为N元素,Y与X形成的NH3分子中有3个共价键;X、W同主族,则W原子的质子数等于Y、Z原子最外层电子数之和,则W为Na,据此分析解答。
根据上述分析,X为H元素,Y为N元素,Z为O元素,W为Na元素。
(1)由上述元素组成的4核10电子的离子为H3O+,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)H与O可分别形成10电子和18电子的分子,分别为H2O、H2O2,过氧化氢在二氧化锰作催化剂条件下分解为水与氧气,反应方程式为:2H2O2 ![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
(3)由X、Y、Z所形成的常见离子化合物是NH4NO3,W的最高氧化物的水化物为NaOH,二者反应的离子方程式为:NH4++OH- ![]() NH3↑+H2O;X与W形成的化合物是NaH,氢化钠和水反应生成氢氧化钠和氢气,反应离子方程式为:NaH+H2O=Na++OH-+H2↑,故答案为:NH4NO3;NH4++OH-
NH3↑+H2O;X与W形成的化合物是NaH,氢化钠和水反应生成氢氧化钠和氢气,反应离子方程式为:NaH+H2O=Na++OH-+H2↑,故答案为:NH4NO3;NH4++OH- ![]() NH3↑+H2O;NaH+H2O=Na++OH-+H2↑;
NH3↑+H2O;NaH+H2O=Na++OH-+H2↑;
(4)用电子式表示W与Z形成Na2O的过程为:![]() ,故答案为:
,故答案为:![]() 。
。

【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |