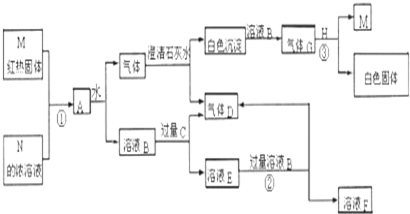
题目内容
7.除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂,加入试剂合理的操作顺序是( )①Na2CO3
②BaCl2
③NaOH
④HCl.
| A. | ①②③④ | B. | ③①②④ | C. | ④②①③ | D. | ③②①④ |
分析 除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去,切不可引入杂质离子,故选用氯化物或钠的化合物即碳酸钠、氢氧化钠、氯化钡,离子都沉淀了,再进行过滤,最后加入盐酸可以除去过量的碳酸钠和氢氧化钠,通过结晶蒸发得到精盐,加入Na2CO3的顺序必须在加入钡离子的后面即可,盐酸最后一步加入,据此进行判断.
解答 解:先加入足量的③NaOH,除去Mg2+,将HCO3-转化成碳酸根;然后加入过量②BaCl2,除去SO42-、CO32-;再加入过量①Na2CO3 除去Ca2+;过滤后,滤液中加入过量的④盐酸,除去溶液中剩余的碳酸根和氢氧化钠中的氢氧根,最后加热除去剩余的氯化氢,
所以合理顺序为:③②①④;
故选D.
点评 本题考查了物质的分离与提纯方法的综合应用,题目难度中等,注意明确除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
18.下列结论正确的是( )
①熔点:Na2O>MgO>SiO2>CO2
②氢化物稳定性:HF>HCl>H2S
③离子还原性:S2->Cl->Br->I-
④氧化性:Fe3+>Cu2+>Fe2+>Na+
⑤酸性:H2SO4>HClO4>H3PO4
⑥非金属性:F>Cl>S>Si.
①熔点:Na2O>MgO>SiO2>CO2
②氢化物稳定性:HF>HCl>H2S
③离子还原性:S2->Cl->Br->I-
④氧化性:Fe3+>Cu2+>Fe2+>Na+
⑤酸性:H2SO4>HClO4>H3PO4
⑥非金属性:F>Cl>S>Si.
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
15.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
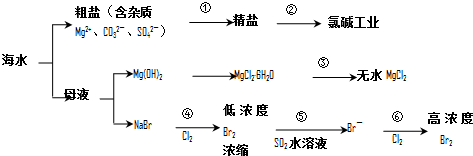
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.

已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗2.24LCl2 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
2.下列除杂质(括号里物质为杂质)的方法正确的是( )
| A. | 甲醛(甲酸):加入NaOH溶液加热,分液 | |
| B. | 苯(苯酚):溴水,过滤 | |
| C. | 乙酸乙酯(乙酸):加入饱和Na2CO3溶液,分液 | |
| D. | 乙烷(乙烯):酸性高锰酸钾溶液,洗气 |
12.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为KW(25℃)=1.0×10-14,K(35℃)=2.1×10-14.下列叙述正确的是( )
| A. | c(H+)随着温度的升高而降低 | |
| B. | 35℃时纯水中c(H+)═c(OH-) | |
| C. | 向水中加入NaHSO4溶液会抑制水的电离 | |
| D. | 向水中加入NaHCO3溶液会抑制水的电离 |
19.下列方法正确的是( )
| A. | 苯的结构中存在碳碳单键 | |
| B. | 苯在一定条件下能发生取代反应 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 苯和乙烯都能与溴水发生反应而使溴水褪色 |
17.有机物A含碳54.5%、氢9.10%、氧36.4%(质量分数),在标准状况下,蒸气密度是1.96g•L-1它易溶于水,其水溶液与新制的氢氧化铜混合,加热到沸腾,有红色沉淀生成.有机物B含碳60%、氢13.33%、氧26.67%(质量分数),蒸气密度是氢气的30倍,它能发生酯化反应.则下列各组中,A、B的结构简式正确的( )
| A. | CH3CHO HCOOCH3 | B. | CH3CH2CHO CH3COOH | ||
| C. | CH3CHO CH3COOH | D. | CH3CHO CH3CH(OH)CH3 |