题目内容
18.下列结论正确的是( )①熔点:Na2O>MgO>SiO2>CO2
②氢化物稳定性:HF>HCl>H2S
③离子还原性:S2->Cl->Br->I-
④氧化性:Fe3+>Cu2+>Fe2+>Na+
⑤酸性:H2SO4>HClO4>H3PO4
⑥非金属性:F>Cl>S>Si.
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
分析 ①晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比;
②元素的非金属性越强,对应的氢化物越稳定;
③元素的非金属性越强,对应离子还原性越弱;
④金属性越弱,其最高价态的离子氧化性最强,金属性越强,其最高价态的离子氧化性最弱,氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
⑤同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
⑥同周期非金属性从左向右增强,同主族从上到下非金属性减弱.
解答 解:①晶格能与离子半径成反比、与电荷成正比,镁离子电荷大于钠离子,钠离子半径大于镁离子,所以晶格能大小MgO>Na2O,熔点由高到低顺序MgO>Na2O,晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,则熔点为SiO2>MgO>Na2O>CO2,故①错误;
②非金属性F>Cl>S,元素的非金属性越强,对应的氢化物越稳定,故②正确;
③元素的非金属性Cl>Br>I>S,对应离子还原性S2->I->Br->Cl-,故③错误;
④金属性Na>Fe>Cu,其最高价态的离子氧化性,Fe3+>Cu2+>Na+,反应Fe+Cu2+=Fe2++Cu中,氧化剂Cu2+的氧化性大于氧化产物Fe2+的氧化性,所以氧化性:Fe3+>Cu2+>Fe2+>Na+,故④正确;
⑤同周期自左而右非金属性增强,非金属性Cl>S>P,非金属性越强,最高价含氧酸的酸性越强,故酸性HClO4>H2SO4>H3PO4,故⑤错误;
⑥F、Cl同主族,同主族从上到下非金属性减弱,非金属性F>Cl,S、Cl、Si同周期,则非金属性F>Cl>S>Si,故⑥正确;
故选C.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,把握元素的位置、性质的变化规律为解答的关键,侧重金属性、非金属性比较的考查,题目难度中等.

| A. | 浓度、温度、压强、催化剂既是影响反应速率的因素又是影响反应限度的因素 | |
| B. | 合成氨反应在一定条件下达到平衡后,N2、H2、NH3物质的量之比保持恒定 | |
| C. | 化学反应的限度决定于反应物的性质,与外界条件无关 | |
| D. | 增大反应物的用量一定会加快反应速率 |
①石油的分馏
②合成乙酸乙酯
③制取乙烯
④制硝基苯
⑤蔗糖水解
⑥葡萄糖溶液的银镜反应
⑦测定KNO3在80℃时的溶解度
⑧制溴苯⑨乙酸乙酯的水解.
| A. | ④⑤⑥⑦⑨ | B. | ③⑤⑥⑦⑧ | C. | ①②③⑤⑦ | D. | ②③⑤⑥⑦ |
 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长,硫化氢的分子空间构型为V形;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
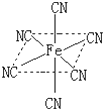
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐,配离子结构如图.
①写出铁元素基态原子价电子排布式3d64s2;
②已知CN-与 N2结构相似,1molCN-中π键数目为2NA;
③写出沉淀溶解的化学方程式Fe(CN)2+4KCN=K4[Fe(CN)6].
| A. | 做银镜反应后的试管用氨水洗涤 | |
| B. | 做碘升华实验后的烧杯用酒精洗涤 | |
| C. | 盛装苯酚后的试管用盐酸洗涤 | |
| D. | 做酯化反应后的试管用饱和Na2CO3溶液洗涤 |
①Na2CO3
②BaCl2
③NaOH
④HCl.
| A. | ①②③④ | B. | ③①②④ | C. | ④②①③ | D. | ③②①④ |
 实验室里用乙醇和浓硫酸来制取乙烯:
实验室里用乙醇和浓硫酸来制取乙烯:
