题目内容
12.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为KW(25℃)=1.0×10-14,K(35℃)=2.1×10-14.下列叙述正确的是( )| A. | c(H+)随着温度的升高而降低 | |
| B. | 35℃时纯水中c(H+)═c(OH-) | |
| C. | 向水中加入NaHSO4溶液会抑制水的电离 | |
| D. | 向水中加入NaHCO3溶液会抑制水的电离 |
分析 A.水的电离是吸热过程,升高温度,平衡正向移动;
B.35℃时纯水,显中性,故c(H+)=c(OH);
C.向水中加入NaHSO4溶液,NaHSO4电离出氢离子,增大氢离子浓度,平衡逆向移动;
D.向水中加入NaHCO3溶液,NaHCO3电离出碳酸氢根离子,碳酸氢根离子结合氢离子生成碳酸,氢离子浓度减小,平衡正向移动.
解答 解:A.水的电离是吸热过程,升高温度,平衡正向移动,c(H+)随着温度的升高而升高,故A错误;
B.35℃时纯水,显中性,故c(H+)=c(OH-),故B正确;
C.向水中加入NaHSO4溶液,NaHSO4电离出氢离子,增大氢离子浓度,平衡逆向移动,故会抑制水的电离,故C正确;
D.向水中加入NaHCO3溶液,NaHCO3电离出碳酸氢根离子,碳酸氢根离子结合氢离子生成碳酸,氢离子浓度减小,平衡正向移动,故会促进水的电离,故D错误;
故选BC.
点评 本题考查水的电离的影响因素,难度不大.要注意基础知识的积累.

练习册系列答案
相关题目
2.用固体NaOH配制一定物质的量浓度的NaOH溶液,下列操作正确的是( )
| A. | 称量时,将固体NaOH放在小烧杯中,再放在天平左盘上 | |
| B. | 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中 |
3. 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长,硫化氢的分子空间构型为V形;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
则X、Y、Z的电负性从大到小的顺序为Al、Mg、Na(用元素符号表示),元素Y第一电离能大于X的原因是因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定;
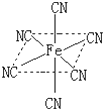
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐,配离子结构如图.
①写出铁元素基态原子价电子排布式3d64s2;
②已知CN-与 N2结构相似,1molCN-中π键数目为2NA;
③写出沉淀溶解的化学方程式Fe(CN)2+4KCN=K4[Fe(CN)6].
 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长,硫化氢的分子空间构型为V形;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐,配离子结构如图.
①写出铁元素基态原子价电子排布式3d64s2;
②已知CN-与 N2结构相似,1molCN-中π键数目为2NA;
③写出沉淀溶解的化学方程式Fe(CN)2+4KCN=K4[Fe(CN)6].
20.下列说法正确的是( )
| A. | 聚乙烯能使溴水褪色 | |
| B. | 油脂是天然高分子化合物 | |
| C. | 葡萄糖分子结构中只有一个醛基,所以是单糖 | |
| D. | 生成高分子化合物的常见反应是加聚反应和缩聚反应 |
7.除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂,加入试剂合理的操作顺序是( )
①Na2CO3
②BaCl2
③NaOH
④HCl.
①Na2CO3
②BaCl2
③NaOH
④HCl.
| A. | ①②③④ | B. | ③①②④ | C. | ④②①③ | D. | ③②①④ |
17.毛巾、口罩要经常用开水蒸煮消毒,其原理是( )
| A. | 使糖水解 | B. | 使油脂水解 | C. | 使氨基酸变性 | D. | 使蛋白质变性 |
4.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列六步操作,下列各组操作顺序合理的是( )
①过滤,
②加稍过量的NaOH溶液,
③向滤液中加适量盐酸,
④加稍过量的Na2CO3溶液,
⑤加稍过量的BaCl2溶液,
⑥将滤液蒸发结晶.
①过滤,
②加稍过量的NaOH溶液,
③向滤液中加适量盐酸,
④加稍过量的Na2CO3溶液,
⑤加稍过量的BaCl2溶液,
⑥将滤液蒸发结晶.
| A. | ②④⑤①③⑥ | B. | ⑤②④①③⑥ | C. | ④②⑤①③⑥ | D. | ②⑤④③①⑥ |
1.下列实验不能达到目的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| B. | 用水鉴别己烷、四氯化碳、酒精三种无色液体 | |
| C. | 将苯和溴水混合制取溴苯 | |
| D. | 可用酸性高锰酸钾溶液鉴别甲烷和乙烯 |
 碘在工农业生产和日常生活中有重要用途.
碘在工农业生产和日常生活中有重要用途.