题目内容
【题目】某小组同学用下图装置进行实验研究(a、b、c表示止水夹)。请评价或完善其方案:
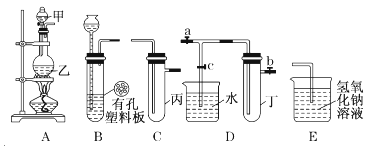
(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①氯元素在周期表中的位置为 。
②A中反应的离子方程式: 。
③E中氢氧化钠溶液的作用 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
④实验Ⅰ推出的相应结论是否合理? ,若不合理,请说明理由(若合理,无需填写) 。
⑤实验Ⅱ推出相应的结论是否合理? ,若不合理,请说明理由(若合理,无需填写) 。
(2)将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2。B中反应的化学方程式 。
【答案】(1)① 第三周期第ⅦA族
②MnO2 + 2Cl- + 4H+![]() Mn2++2H2O +Cl2↑
Mn2++2H2O +Cl2↑
③吸收多余的Cl2(尾气处理);
④不合理,没有事先证明干燥的氯气有无漂白性;
⑤不合理,制取的氯气中含HCl气体,其溶于水能与NaHCO3粉末反应产生气泡
(2)Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
【解析】
试题分析:(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①氯元素在周期表中的位置为第三周期第ⅦA族。
②A中反应的离子方程式:MnO2 + 2Cl- + 4H+![]() Mn2++2H2O +Cl2↑。
Mn2++2H2O +Cl2↑。
③氯气有毒,E中氢氧化钠溶液的作用吸收氯气,防止污染;
④没有事先证明干燥的氯气有无漂白性;氯气没有漂白性,所以不合理;⑤制取的氯气中含HCl气体,其溶于水能与NaHCO3粉末反应产生气泡,不能证明氯气与水反应的产物具有酸性;(2)浓硝酸和铜片反应的化学方程式Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O。

 阅读快车系列答案
阅读快车系列答案