题目内容
【题目】
(1)收集氨气时,可采用向 (填“上”或“下”)排空气法;
(2)下列四组实验装置常用于物质的分离和提纯.
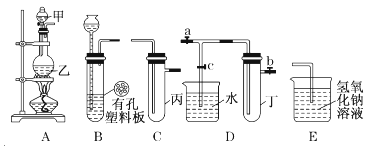
①A中仪器a的名称为 ;
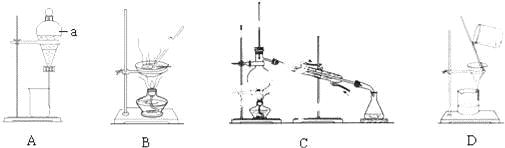
②若要通过蒸馏的方法淡化海水,应选择的装置为 (填装置代号,下同);③若要从食盐溶液中得到食盐晶体,应选择的装置为 ;www-2-1-cnjy-com
④若要除去食盐水中不溶性的泥沙等杂质,应选择的装置为 .
【答案】(1)下;
(2)①分液漏斗;②C;③B;④D.
【解析】试题分析:(1)依据氨气密度小于空气密度的物理性质选择排气收集方式;
(2)①根据装置图判断仪器;
②通过蒸馏的方法淡化海水,选择蒸馏装置;
③从食盐溶液中得到食盐晶体,应选择蒸发结晶装置;
④除去食盐水中不溶性的泥沙等杂质,应选择过滤装置.
解:(1)氨气密度小于空气密度,应选择向下排气法收集;
故答案为:下;
(2)①由图可知,仪器a为分液漏斗,故答案为:分液漏斗;
②通过蒸馏的方法淡化海水,选择蒸馏装置,只有C为蒸馏装置,故答案为:C;
③从食盐溶液中得到食盐晶体,应选择蒸发结晶装置,只有B为蒸发装置,故答案为:B;
④除去食盐水中不溶性的泥沙等杂质,应选择过滤装置,只有装置D符合,故答案为:D.

 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案【题目】已知J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。请回答下列问题:
J | ||||
R |
(1)M的离子结构示意图为______________________________;
(2)元素T在周期表中的位置是______________________________。
(3)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________ ______________________。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(ΔH>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________(选填序号)。
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
(4)由J、R形成的液态化合物JR20.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ。该反应的热化学方程式为_______________________________ 。