题目内容
【题目】将可能含有少量碳、硅杂质的a克镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。
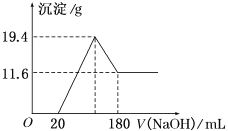
(1)原合金中Mg、Al的质量各是多少?
(2)盐酸的物质的量浓度是多少?
(3)取过滤后所得滤渣,向其中加入足量1mol/L NaOH溶液,可生成标准状况下0.112LH2,则a的最小值是多少?
【答案】(1)Mg:4.8g Al:2.7g
(2)8mol/L(3)7.57g
【解析】
试题分析:(1)根据图像可知,加入NaOH溶液0--20mL过程中并没有产生沉淀,这说明反应中盐酸剩余,加入的氢氧化钠与盐酸发生中和反应,则反应方程式为HCl + NaOH═NaCl+ H2O。继续加入氢氧化钠溶液开始出现沉淀,当沉淀达到最大值时,再加入氢氧化钠溶液沉淀开始减少,这说明此时氢氧化铝开始溶解在氢氧化钠溶液中,所以160—180mL过程中反应方程式为Al(OH)3 + NaOH ═NaAlO2 +2 H2O。
(2)溶解氢氧化铝消耗的氢氧化钠溶液体积是180ml—160ml=20ml,根据Al(OH)3+OH-=AlO2-+2H2O,所以铝离子的物质的量是5mol/L×0.02L=0.1mol,铝的质量是2.7g;根据方程式Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,生成氢氧化铝沉淀需要氢氧化钠溶液的体积是60ml,则与镁离子结合的氢氧化钠溶液的体积是160ml—20ml—60ml=80ml,物质的量是5mol/L×0.08L=0.4mol。所以根据方程式Mg2++2OH-=Mg(OH)2↓,可知镁离子的物质的量是0.2mol,因此根据原子守恒可知金属镁的质量是0.2mol×24g/mol=4.8g;当沉淀达到最大值时消耗氢氧化钠是160ml,物质的量是0.8mol,溶液中生成得氯化钠是0.8mol,因此根据氯离子守恒可知所用HCl 的物质的量浓度为0.8mol÷0.1L=8mol/L。(3)过滤后所得滤渣中含有硅,向其中加入足量1mol/L NaOH溶液,发生反应![]() ,
,
根据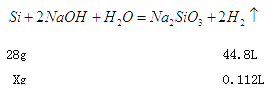
X=0.07g
则a的最小值是多少2.7g+4.8g+0.07g=7.57g。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案