题目内容
15. 有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验:
有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验:①加入浓溴水,溶液变为黄褐色;
②加入淀粉,未见蓝色;
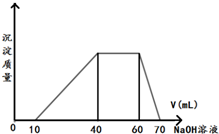
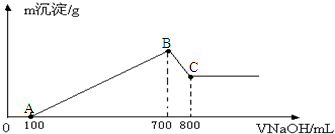
③逐滴加入1mol•L-1NaOH溶液,随NaOH溶液的滴入,产生沉淀的量如图所示.
试确定溶液中一定存在的离子及各离子物质的量分别是H+0.01mol、Al3+0.01mol、NH4+0.02mol、I-0.06mol.
分析 加入浓溴水,溶液变为黄褐色,说明生成碘,则含有I-,Fe3+能把I-氧化为碘单质,淀粉遇碘变蓝色,溶液未变蓝说明无Fe3+,由图象可知氢氧化钠溶液先后分别与H+、Mg2+和Al3+、NH4+、Al(OH)3反应,则不含Mg2+,故溶液中一定含有H+、Al3+、NH4+,因沉淀完全溶解,三种离子均可与CO32-发生反应,因此溶液中无CO32-,结合对应图象的数据计算各离子的物质的量,以此解答该题.
解答 解:加入浓溴水,溶液变为黄褐色,说明生成碘,则含有I-,Fe3+能把I-氧化为碘单质,淀粉遇碘变蓝色,溶液未变蓝说明无Fe3+,由图象可知氢氧化钠溶液先后分别与H+、Mg2+和Al3+、NH4+、Al(OH)3反应,则不含Mg2+,故溶液中一定含有H+、Al3+、NH4+,因沉淀完全溶解,三种离子均可与CO32-发生反应,因此溶液中无CO32-,
氢氧化钠与氢离子反应消耗的物质的量为:1mol•L-1×0.01L=0.01mol,因此n(H+)=0.01mol;
溶解氢氧化铝消耗的氢氧化钠的物质的量为1mol•L-1×0.01L=0.01mol,因此n(Al3+)=n[Al(OH)3]=0.01mol;
与铵根离子反应的氢氧化钠的物质的量为1mol•L-1×0.02L=0.02mol,则n(NH4+)=0.02mol,
溶液存在n(H+)+3n(Al3+)+n(NH4+)=n(I-),则n(I-)=0.01mol+0.01mol×3+0.02mol=0.06mol,
故答案为:H+0.01mol、Al3+ 0.01mol、NH4+ 0.02mol、I-0.06mol.
点评 本题考查离子的检验,侧重于学生的分析、计算能力的考查,对于图象分析题的解题规律:要明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析.

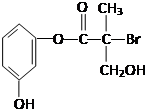
| A. | 该有机物与浓溴水可发生取代反应 | |
| B. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 该有机物能与Na、Na2CO3、NaHCO3溶液发生反应 | |
| D. | 该有机物经催化氧化后与银氨溶液水浴加热,可生成光亮的银镜 |
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.1molN5+离子中所含的电子数为3.4NA | |
| C. | 5.6g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 用溶有1molFeCl3的饱和溶液制Fe(OH)3胶体,制成的胶体中含有的胶粒数为1.0NA |
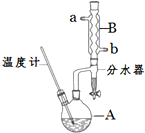 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振荡后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加入正丁醇,再加入浓硫酸.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓硫酸,振荡后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
(7)本实验中,正丁醚的产率为34%.(保留两位有效数字)
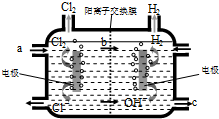 如图为工业上氯碱工业的电解槽示意图,据图回答:
如图为工业上氯碱工业的电解槽示意图,据图回答: