题目内容
3.一无色气体,可能是由CO2、HCl、NH3、NO2、NO、H2中的一种或几种所组成,将此无色气体通过盛有浓硫酸的洗气瓶,发现气体减少一部分体积,继续通过装有固体Na2O2的干燥管,发现从干燥管出气管端出来的气体颜色显红棕色,再将该气体通入盛满水倒立于水槽中的试管,最后气体全部被吸收,试管内仍然为一满试管液体,由此可确定:(1)原气体一定含有NH3、CO2、NO,一定不会有N2、NO2、H2;
(2)由最终结果可知原气体中CO2、NO气体的体积比为3:2.
分析 气体为无色,则一定不含有红棕色的NO2;
通过盛有浓硫酸的洗气瓶,发现气体减少一部分体积,说明一定含有与浓硫酸反应的NH3;
继续通过装有Na2O2固体的干燥管,发现从干燥管出来的气体颜色呈红棕色,说明含有CO2和NO,CO2和过氧化钠反应生成氧气,氧气和NO反应生成红棕色气体NO2;
继续将气体通入盛满水倒立于水槽中的试管内,最后气体完全被吸收,试管内仍然充满液体,说明不含不溶于水的N2、H2,以此解答该题.
解答 解:混合气体为无色,则一定不含有红棕色的气体NO2;
通过盛有浓硫酸的洗气瓶,发现气体体积减少一部分,说明混合气体中含有与浓硫酸发生反应的气体NH3;
继续通过装有Na2O2固体的干燥管,发现从干燥管出来的气体颜色呈红棕色,该红棕色气体为二氧化氮,说明原混合气体中含有CO2和NO,CO2和过氧化钠反应生成氧气,氧气和NO反应生成红棕色气体NO2;
再继续将气体通入盛满水倒立于水槽中的试管内,最后气体完全被吸收,试管内充满液体,说明原混合气体中不含不溶于水的气体N2、H2,
(1)由以上分析可知,混合气体中一定含有的气体为:NH3、CO2、NO,一定不含有的气体为:N2、NO2、H2,
故答案为:NH3、CO2、NO;N2、NO2、H2;
(2)CO2和过氧化钠反应生成氧气,反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,氧气和NO反应生成红棕色气体NO2,反应的方程式为2NO+O2=2N02,
故答案为:2Na2O2+2CO2=2Na2CO3+O2,2NO+O2=2N02;
(3)CO2和过氧化钠反应生成氧气,氧气和NO反应生成红棕色气体NO2,气体完全溶于水,说明没有氮气;氧气和二氧化氮与水完全反应生成硝酸,发生4NO2+O2+2H2O=4HNO3,设有4molNO2,则应有4molNO,反应2NO+O2=2N02和4NO2+O2+2H2O=4HNO3共需要氧气为:2mol+1mol=3mol,
由方程式2Na2O2+2CO2=2Na2CO3+O2可知,混合气体中应含有6molCO2,则n(CO2):n(NO)=6:4=3:2,
故答案为:CO2、NO;3:2.
点评 本题考查物质的检验和鉴别的实验设计,题目难度中等,注意掌握常见气体的性质及检验方法,试题侧重于学生的分析能力和计算能力的考查,为高频考点,注意相关基础知识的积累.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案| A. | 0.15 mol/L | B. | 0.20 mol/L | C. | 0.25 mol/L | D. | 0.40 mol/L |
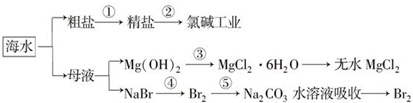
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业进行制取 | |
| C. | 第③步中结晶出的MgCl2•6H2O可在空气中受热分解制无水MgCl2 | |
| D. | 第④步中溴元素被氧化,第⑤步中既有溴元素被氧化也有溴元素被还原 |
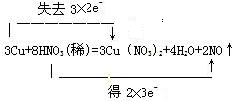 .
. .
.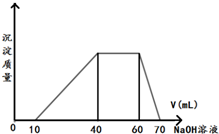 有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验:
有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验: