题目内容
【题目】下表是元素周期表的一部分,回答下列有关问题:
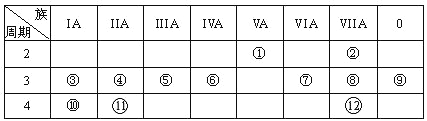
(1)画出原子的结构示意图:④______________
(2)在①~12元素中,金属性最强的元素是______,非金属性最强的元素是____,最不活泼的元素是_____。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)元素⑤的最高价氧化物的水化物分别与元素③⑧的最高价氧化物的水化物反应的离子方程式_________, _________
(5)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素它们可以形成化合物,用电子式表示其形成过程:__________。
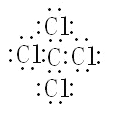
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:______________________
【答案】![]() K F Ar Cl b Al(OH)3 + OH- =AlO2- + 2H2O Al(OH)3 +3H+ =Al3+ + 3H2O
K F Ar Cl b Al(OH)3 + OH- =AlO2- + 2H2O Al(OH)3 +3H+ =Al3+ + 3H2O ![]()
![]() +4
+4![]() →
→
【解析】
根据元素周期表,推出①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,另外两个依次为Ca、Br,然后据此分析;
(1)根据元素周期表,④为Mg,其原子结构示意图为![]() ;
;
(2)依据同周期从左向右金属性减弱,非金属性增强(稀有气体除外),同主族从上到下金属性增强,非金属性减弱,推出12种元素中金属性最强的是K,非金属性最强的是F;稀有气体最不活泼,因此12种气体最不活泼的是Ar;
(3)根据(2)的分析,⑦⑧中非金属性最强的是Cl,a、物质的状态与非金属性强弱无关,故a不符合题意;
b、非金属性越强,其气态氢化物越稳定,Cl的非金属性强于S,则HCl的稳定性强于H2S,故b符合题意;
c、单质都能与氢氧化钠溶液反应无法判断非金属性强弱,故c不符合题意;答案选b;
(4)⑤的最高价氧化物对应水化物是Al(OH)3,③、⑧最高价氧化物对应水化物分别是NaOH和HClO4,因为Al(OH)3表现两性,因此分别与NaOH和HClO4反应离子方程式为Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;
(5)依据原子半径大小比较规律,第三周期中原子半径最大的是Na,原子半径最小的是Cl,两者形成的化合物为NaCl,氯化钠为离子化合物,![]() ;
;
(6)最外层电子是其次外层电子数的2倍,该元素为C,与Cl形成AB4型的化合物,该化合物为CCl4,四氯化碳为共价化合物,![]() +4
+4![]() →
→ 。
。

【题目】对于数以千万计的化学物质和为数更多的化学反应,分类的作用几乎是无可替代的。下列物质分类的正确组合是( )
混合物 | 化合物 | 单质 | 盐 | |
A | 盐酸 | NaOH溶液 | 石墨 | 食盐 |
B | 生理盐水 | KNO3晶体 | O3 | 纯碱 |
C | 氢氧化铁胶体 | 澄清石灰水 | 铁 | 石灰石 |
D | CuSO4·5H2O | CaCl2 | 水银 | CaO |
A.AB.BC.CD.D
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。