题目内容
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A.原子半径由小到大的顺序:X<Y<Z<W
B.Y单质在一定条件下可以与氧化铁发生置换反应
C.室温下,0.1 mol· W的气态氢化物的水溶液的pH>1
W的气态氢化物的水溶液的pH>1
D.Z的最高价氧化物能与水反应生成相应的酸
B
【解析】根据题意:Y元素的单质既能与盐酸反应也能与NaOH溶液反应,知Y为Al,在2、3周期的元素中最外层电子数是次外层电子数的一半的为Si,即Z为Si,又因Y、Z、W原子的最外层电子数之和为14,则W为Cl;X与Z同主族,故X为C。原子半径:X(C)<W(Cl)<Z(Si)<Y(Al),A项错误;Al在高温条件下与氧化铁发生铝热反应即置换反应,B项正确;W的气态氢化物为HCl,其水溶液为盐酸,是强酸,当浓度为0.1 mol·L-1时,其pH=1,C项错误;Si的最高价氧化物SiO2与水不反应,D项错误。

 名校课堂系列答案
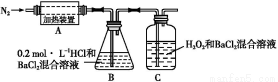
名校课堂系列答案某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种,为确定该固体混合物的成分及各组成成分的物质的量之比,现进行如下实验。
实验Ⅰ:

(1)无色气体为 。
(2)该固体混合物的成分为 。
实验Ⅱ:取一定量的该固体混合物溶于水配成1 L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示。
Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
n(A-)/mol | 1.25 | 1.5 | 2 |
n(B-)/mol | 1.5 | 1.4 | 0.9 |
n(C-)/mol | a | 0 | 0 |
(3)a= 。
(4)原固体混合物中各组成成分的物质的量之比为 。