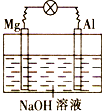
题目内容
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g).
Si3N4(s)+6CO(g).
(1)该反应的平衡常数表达式为K=_______;
(2)若知上述反应为放热反应,则其反应热ΔH_____0(填“>”“<”或“=”);升高温度,其平衡常数值___(填“增大”“减小”或“不变”));若已知CO生成速率为v(CO)=15mol·L-1·min-1,则N2消耗速率为v(N2)=______;
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t2时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是________。

【答案】 ![]() < 减小 5mol/(L·min) 减小压强或降低温度 t3~t4
< 减小 5mol/(L·min) 减小压强或降低温度 t3~t4
【解析】试题分析:(1)根据平衡常数的定义写平衡常数表达式;(2)放热反应,焓变小于0;升高温度,平衡逆向移动;根据速率比等于系数比计算N2消耗速率;(3)根据速率变化和平衡移动方向分析改变的条件。t2~t3平衡正向移动,t4~t5平衡逆向移动,t6~t7平衡没移动。
解析:(1)根据平衡常数的定义,3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g),平衡常数表达式是
Si3N4(s)+6CO(g),平衡常数表达式是![]() ;(2)放热反应,焓变<0;升高温度,平衡逆向移动,平衡常数值减小;速率比等于系数比, N2消耗速率为15mol·L-1·min-1
;(2)放热反应,焓变<0;升高温度,平衡逆向移动,平衡常数值减小;速率比等于系数比, N2消耗速率为15mol·L-1·min-1![]() =5mol·L-1·min-1;(3)t2时正逆反应速率都较原平衡时的速小,可降低温度或减小压强,t2时V(正) > V(逆),平衡正向移动,可能降温或减压,所以t2时改变的条件可能是能降温或减压; t2~t3平衡正向移动,t4~t5平衡逆向移动,t6~t7平衡没移动,所以t3~t4时平衡混合物中CO的含量最高。
=5mol·L-1·min-1;(3)t2时正逆反应速率都较原平衡时的速小,可降低温度或减小压强,t2时V(正) > V(逆),平衡正向移动,可能降温或减压,所以t2时改变的条件可能是能降温或减压; t2~t3平衡正向移动,t4~t5平衡逆向移动,t6~t7平衡没移动,所以t3~t4时平衡混合物中CO的含量最高。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).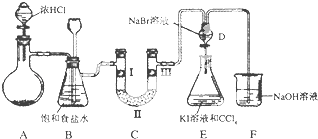
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是 , 若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入;(提示:硅胶是干燥剂,不与氯气反应)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为 , 若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是 .