题目内容
14.雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为1:1.
(2)上述反应中的氧化剂是As2S3,反应产生的气体可用氢氧化钠溶液或硫酸铜溶液吸收.
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-→2H3AsO4+3S+10NO2↑+2H2O若生成2mol H3AsO4,则反应中转移电子的物质的量为10mol.若将该反应设计成原电池,则NO2应该在正极(填“正极”或“负极”)附近逸出.
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量a(选填编号).
a.小于0.5mol b.等于0.5mol c.大于0.5mol d.无法确定.
分析 (1)根据反应物和生成物来分析反应,则利用氧化还原反应反应中得失电子守恒来分析完全反应的物质的量之比来解答;
(2)根据反应物中某元素化合价的降低来分析氧化剂,并利用气体的性质来分析气体的吸收;
(3)根据氧化还原反应中生成的H3AsO4的物质的量与转移电子数的关系来计算,利用原电池中正极发生还原反应,则某元素的化合价降低来解答;
(4)根据NO2与11.2L O2(混合后用水吸收全部转化成浓HNO3,再利用碳与浓硝酸的反应来分析解答.
解答 解:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,则反应为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S,As元素化合价+3价变化为+2价,根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,则二者的物质的量之比是1:1,
故答案为:1:1;
(2)因As2S3在该反应中As元素的化合价降低,则As2S3为氧化剂,又H2S是还原性气体可用碱液吸收或硫酸铜溶液吸收,
故答案为:As2S3;氢氧化钠溶液或硫酸铜溶液;
(3)由反应As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O可知,As2S3作还原剂,转移电子数为2×(5-3)+3×(0+2)=10,
则生成2molH3AsO4时反应中转移电子的物质的量为10mol,又原电池中正极发生还原反应,则某元素的化合价降低,由反应可知N元素的
化合价由+5降低到+4,则NO2属于还原产物,在正极生成,故答案为:10mol;正极;
(4)由NO2与11.2LO2混合后用水吸收全部转化成浓HNO3,则4NO2+O2+2H20═4HNO3,氧气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
则由反应可知硝酸的物质的量为0.5mol×4=2mol,
若硝酸完全反应,则根据电子守恒可知生成CO2的量是0.5mol×$\frac{4}{4}$=0.5mol,
但考虑到随着反应到进行,硝酸的浓度会降低而稀硝酸不与碳反应,则产生的CO2的量小于0.5mol,故答案为:a.
点评 本题考查氧化还原反应中的有关计算,明确物质中元素的化合价、电子守恒、物质的性质是解答的关键,并注意化学反应的发生对物质浓度的要求来解答即可,题目难度中等.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案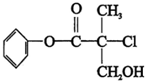
| A. | 有机物A 属于芳香烃 | |
| B. | 有机物A 可以与Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A 与浓硫酸混合加热,可以发生消去反应 | |
| D. | 有机物A 可与NaOH 溶液反应,生成多种可溶于水的化合物 |
| A. | 该溶液中一定含有SCN- | B. | 氧化性:Fe2+>Cl2 | ||
| C. | Fe2+与SCN-不能形成红色物质 | D. | Fe2+被氧化为Fe3+ |
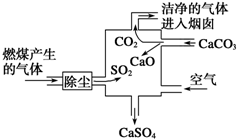
| A. | 进入烟囱的气体为混合物 | |
| B. | 此过程中硫元素的化合价没有发生改变 | |
| C. | 使用此废气处理装置可减少酸雨的形成 | |
| D. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 |
| A. | 常温常压下,3.0g乙烷中含有的碳氢键数为0.7NA | |
| B. | 标准状况下,22.4L C2H5OH中含有的氢原子数为6NA | |
| C. | 常温常压下,92 g的 NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 标准状况下,由Na2O2制得11.2 LO2,反应转移的电子数为0.5NA |
①把工厂烟囱造高 ②燃料脱硫 ③开发洁净能源 ④在酸化土壤中加入石灰⑤用煤作燃料.
| A. | ①②⑤ | B. | ①②③④ | C. | ②③ | D. | ②④⑤ |
| A. | 侯德榜提出的联合制碱法可大大提高氯化钠的利用率 | |
| B. | 具有永久硬度的硬水可以采用加热的方法进行软化 | |
| C. | CO.CH4、CH3OH是一碳化学的主要原料 | |
| D. | 复合材料一般由起黏结作用的基体和起增强作用的增强体构成 | |
| E. | 油脂和氢氧化钠共热产生的混合物,加入食盐可使肥皂析出. |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应:2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②Ⅳ中检测Cl2的实验方法取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论(写出两点):通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl-放电.
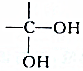 结构的有机物不能稳定存在,根据以上信息,试回答:
结构的有机物不能稳定存在,根据以上信息,试回答: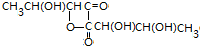 +2H2O,是酯化反应.
+2H2O,是酯化反应.