题目内容
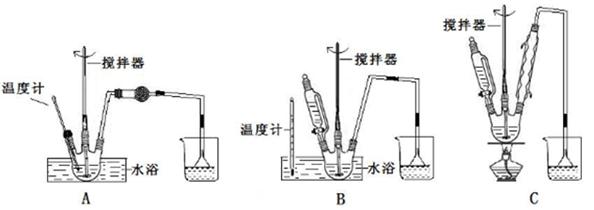
某化学小组采用下图装置模拟电解饱和食盐水制备氢气,通过氢气还原氧化铜测定Cu的相对原子质量,同时检验氯气的氧化性(图中夹持和加热仪器已经略去)。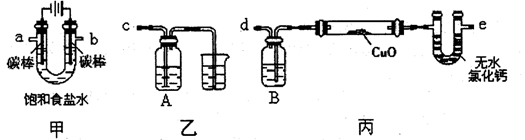
(1)写出装置甲中反应的离子方程式 。为完成上述实验,正确的连按方式为a连接 ,b连接 (填字母)。
(2)①装置乙烧杯中液体的作用是 。A瓶内盛装的溶液最好是 (填字母)。
a.I-淀粉溶液 b.NaOH溶液
c.FeCl2与KSCN混合溶液 d.Na2SO3溶液
②加热装置丙中的氧化铜粉末之前,除了要检查该装置的气密性还需进行的必要操作是 。
(3)利用装置丙测定Cu的相对原子质量,现有两种方案:①测得反应前后洗气瓶B及其中液体质量差m1,②测得反应前后U形管及其中固体质量差m2。你认为合理的方案为 (填“①”或“②”)。若采用测得反应后硬质玻璃管中剩余固体的质量m3的方案,已知O的相对原子质量为16,实验中氧化铜样品质量为m,则测定Cu的相对原子质量的表达式为 ,该方案在反应后硬质玻璃管冷却过程中没有一直通氢气,会导致测定Cu韵相对原子质量 (填“偏大”、“偏小”或“无影响”),理由是 。
(16分)(1)2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分) e c(2分)
2OH-+H2↑+Cl2↑(2分) e c(2分)
(2)①吸收多余的氯气,防止环境污染(2分);c(2分)
②排净装置内的空气(或检验氢气的纯度)(2分)
(3)①(1分);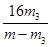 (2分);偏大(1分);反应生成的铜被空气的氧气氧化使m3数据增大,导致测定结果偏大(2分)
(2分);偏大(1分);反应生成的铜被空气的氧气氧化使m3数据增大,导致测定结果偏大(2分)
解析试题分析:(1)电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,溶液中同时生成氢氧根离子,所以电解反应离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑;要检验氯气的氧化性,则氯气连接具有还原性的物质且反应现象要明显,故选c;氢气还原还原性,利用氢气还原氧化铜来检验氢气。但由于电解得到的氢气中含有水蒸气,所以在实验前要除去水蒸气,故选e。
2OH-+H2↑+Cl2↑;要检验氯气的氧化性,则氯气连接具有还原性的物质且反应现象要明显,故选c;氢气还原还原性,利用氢气还原氧化铜来检验氢气。但由于电解得到的氢气中含有水蒸气,所以在实验前要除去水蒸气,故选e。
(2)①氯气有毒,不能直接排放到空气中。氯气可以用碱性物质来处理,所以装置乙烧杯中液体的作用是吸收多余的氯气,防止环境污染;氯气具有强氧化性,能氧化还原性的物质,要检验氯气,必须选用还原性的物质且反应现象明显,则:
a.氯气能氧化碘离子生成单质点,碘遇淀粉显蓝色。但氯气和水反应生成的次氯酸也能使溶液褪色,所以无法证明氯气的氧化性,故a不选;
b.氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠,反应现象不明显,故b不选;
c.氯气能把亚铁离子氧化成三价铁离子,铁离子和硫氰化钾溶液反应生成血红色溶液,反应现象明显,且能检验氯气的氧化性,故c正确;
d.氯气能氧化亚硫酸钠生成硫酸钠,但反应前后溶液颜色不变,反应现象不明显,d不选,答案选c。
②氢气是可燃性气体,与氧气混合,加热容易发生爆炸危险,所以加热氧化铜之前要通入氢气排净装置内的空气。
(3)①中质量的差量是氢气还原氧化铜得到的物质,与铜有关,所以能计算铜的相对原子质量。②中质量的差量是氢气中原来的水蒸气,与铜无关,所以不能计算铜的相对原子质量,因此答案选①。硬质玻璃管中的质量差就是氧的质量=m-m3,设铜的相对原子质量为x,则CuO——O
1mol 16g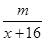 m-m3
m-m3
解得x=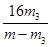
如果反应后硬质玻璃管冷却过程中没有一直通氢气,会导反应生成的铜被空气的氧气氧化使m3数据增大,所以导致测定结果偏大。
考点:考查电解饱和食盐水、氯气和氢气的检验、尾气处理、相对原子质量的测定和计算以及误差分析等

 口算能手系列答案
口算能手系列答案葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
(5)第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4。溶液中得到蓝色沉淀。关于沉淀的成分,有以下几种假设:
假设1:沉淀是CuCO3;
假设2:沉淀是Cu(OH)2;
假设3:沉淀是_____________________________________。
(1)若假设1成立,则发生反应的离子方程式为_______________________________。
(2)若假设2成立,原因是__________________________________________________。
(3)该研究性学习小组拟用以下装置测定沉淀成分,请完成下表。已知:①CuCO3和Cu(OH)2均不带结晶水;②装置气密性良好;③原装置中的空气对实验结果的影响可忽略。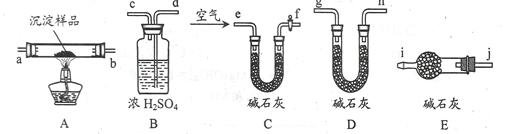
| 实验步骤 | 预期现象 | 结论 |
| ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→___→___→___→___→j→i顺序连接。 | | |
| ②称取一定质量的沉淀______________________,然后___________________,冷却后再称量B、D的质量分别为m3、 m4 | (1)若m1 = m3,m2 < m4 (2)若m1___m3,m2___m4 (3)若ml___m3,m2___m4 | (1)假设1成立 (2)假设2成立 (3)假设3成立 |
(4)若沉淀样品的质量为w克,装置B质量增加了x克,则沉淀中Cu(OH)2的质量分数为__________________________。[已知Cu(OH)2的式量为98]
乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ. 探究银镜反应的最佳实验条件部分实验数据如下表:
| 实验变量 实验序号 | 银氨溶液 /mL | 乙醛的量 /滴 | 水液温度/℃ | 反应混合液的PH | 出现银镜时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
请回答下列问题:
(1)读表若只进行实验1和实验3,其探究目的是 。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是 ;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的 。
(3)进一步实验 若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
。
Ⅱ. 探究对废液的回收处理:
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程为:
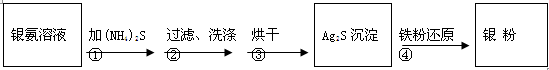
操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为:Ag2S+Fe+2HCl
 2 Ag+ FeCl2+H2S↑。
2 Ag+ FeCl2+H2S↑。(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为: ,需要用到的玻璃仪器有 (填编号)。
a b c d e f g
(5)操作④应在(填实验室设备名称) 中进行。
(6)要洗去试管壁上的银镜,采用的试剂是 (填名称)。
现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复)。
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
③C溶液
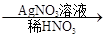 白色沉淀。请回答下列问题:
白色沉淀。请回答下列问题:(1)写出下列物质的化学式:A______________、B______________。
(2)写出“C溶液
 白色沉淀”有关反应的离子方程式____________________________。
白色沉淀”有关反应的离子方程式____________________________。(3)D、E两种物质中必有一种是_______________,写出将少量该物质的溶液滴加到B溶液中反应的离子方程式___________________________________________________________________。
(4)请你设计实验确定C及另一种未知物各是什么物质。(只许在A~E中选择检验试剂)
| 实验步骤 | 预期现象和结论 |
| 取适量C的溶液于试管中, ① 。 | 预期现象和结论1: ② ; 预期现象和结论2: ③ ; |
Fridel—Crafts反应是向苯环上引入烷基最重要的方法,在合成上有很大的实用价值,该反应可以简单表示如下:Ar+RX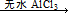 ArR+HX △H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示:
ArR+HX △H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示:
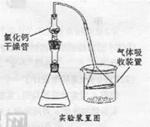
试回答下列问题:
(1)实验装置烧杯中漏斗的作用是________。
(2)巳知Fridel—Cxafts反应是放热反应,为防止叔丁基氣的蒸气被大量的HCl气体带走而影响产率,应将锥形瓶置于_______(填“冷水浴”或“热水浴”)中。
(3)有机层中加入饱和氣化钠溶液及饱和碳酸氢钠溶液的作用可能是_______。通过 操作可将叔丁基氯粗产物转化为较为纯净的叔丁基氯。
(4)某同学因去掉该制备装置中的氣化钙干燥管,发现产率很低(观察不到对叔丁基苯酚白色固体)且锥形瓶中有大量的白雾,他推测是作催化剂的AlCl3发生强烈水解所致,该同学设计如下实验方案进行验证,请完成下表内容。
| 实验方案 | 实验现象 | 能否说明水解 |
| ①将锥形瓶中白雾通入HNO3酸化的AgNO3溶液 | | |
| ②将充分冒白雾后的液体抽滤,得不溶性固体,将固体分成两份, 。 | 两份固体均溶解 | |
(5)若上述同学称取了9.4g苯酚与适量叔丁基氯反应,从反应液中提取出对叔丁基苯酚,将其配成100mL乙醇溶液,移取25.00mL溶液,滴定,消耗NaOH物质的量为5×10-4moL,则以苯酚为基准计算对叔丁基苯酚产率的表达式为_______。
化学与人类生活密切相关,下列与化学有关的说法不正确的是
| A.开发和推广新能源是实现低碳生活的途径之一 |
| B.化学药品着火,要立即用水或泡沫灭火器灭火 |
| C.食品添加剂虽能改善食物味道等,但需限量使用 |
| D.化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 |
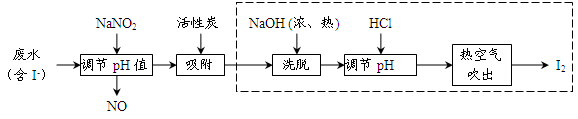
 (棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。
(棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。