题目内容
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4。溶液中得到蓝色沉淀。关于沉淀的成分,有以下几种假设:
假设1:沉淀是CuCO3;
假设2:沉淀是Cu(OH)2;
假设3:沉淀是_____________________________________。
(1)若假设1成立,则发生反应的离子方程式为_______________________________。
(2)若假设2成立,原因是__________________________________________________。
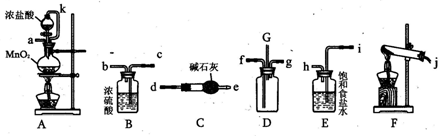
(3)该研究性学习小组拟用以下装置测定沉淀成分,请完成下表。已知:①CuCO3和Cu(OH)2均不带结晶水;②装置气密性良好;③原装置中的空气对实验结果的影响可忽略。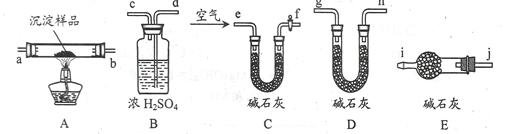
| 实验步骤 | 预期现象 | 结论 |
| ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→___→___→___→___→j→i顺序连接。 | | |
| ②称取一定质量的沉淀______________________,然后___________________,冷却后再称量B、D的质量分别为m3、 m4 | (1)若m1 = m3,m2 < m4 (2)若m1___m3,m2___m4 (3)若ml___m3,m2___m4 | (1)假设1成立 (2)假设2成立 (3)假设3成立 |
(4)若沉淀样品的质量为w克,装置B质量增加了x克,则沉淀中Cu(OH)2的质量分数为__________________________。[已知Cu(OH)2的式量为98]
(16分)
假设3:CuCO3和Cu(OH)2的混合物(2分)
(1)Cu2+ + CO32-=CuCO3↓ (2分)
(2)发生水解反应(1分),且Cu(OH)2比CuCO3更难溶(1分)
(3)实验步骤 预期现象 结论 ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→d→c→g→h或d→c→h→g(2分)→j→i顺序连接。 ②称取一定质量的沉淀于A中充分加热,然后从e口通入足量空气(2分),冷却后再称量B、D的质量分别为m3、m4 (1)若m1 = m3,m2 < m4
(2)若m1_<__m3,m2_=__m4
(3)若ml_<__m3,m2_<__m4(4分)(1)假设1成立
(2)假设2成立
(3)假设3成立
(4)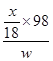 ×100%(或
×100%(或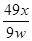 ×100%、49x/9w、4900x/9w%)(2分)
×100%、49x/9w、4900x/9w%)(2分)
解析试题分析:假设1说明碳酸铜是蓝色沉淀,假设2说明氢氧化铜是蓝色沉淀,则蓝色沉淀也可能是碳酸铜和氢氧化铜的混合物,由此确定假设3的内容;(1)若假设1成立,说明碳酸钠与硫酸铜直接发生复分解反应,生成碳酸铜沉淀和硫酸钠,即该反应实质为Cu2++CO32-=CuCO3↓;(2)若假设2成立,可能的原因是铜离子发生水解反应,且氢氧化铜比碳酸铜更难溶;(3)①读图,装置C的作用除去空气中的二氧化碳和水蒸气,防止干扰,所以该装置应放在最左边;A的作用是使蓝色固体受热分解,通过检验其分解产物是否有水蒸气、二氧化碳判断蓝色沉淀的组成;由于碱石灰既能吸收水又能吸收二氧化碳,浓硫酸只能吸收水,因此必须先通过盛有浓硫酸的洗气瓶,后通过盛有碱石灰的干燥器或U形管;为了防止右边装置外空气中的水蒸气和二氧化碳对实验造成干扰,还需要一个盛有碱石灰的U形管或干燥管;由于洗气时气体必须长进短出,U形管左进右出或右进左出都可以,则称量B、D的质量分别为m1、m2,将装置按f→a→b→d→c→g→h→j→i或f→a→b→d→c→h→g→j→i;称取一定质量的沉淀于A中充分加热,然后从e口通入足量空气,冷却后再称量B、D的质量分别为m3、m4,若m1= m3,m2< m4,说明沉淀分解产物没有水蒸气、只有二氧化碳,则假设1成立;若m1< m3,m2= m4,说明沉淀分解产物只有水蒸气、没有二氧化碳,则假设2成立;若m1<m3,m2< m4,说明沉淀分解产物既有水蒸气、又有二氧化碳,则假设3成立;(4)装置B增加的质量就是分解产物水的质量,由于n=m/M,则水的物质的量为x/18mol;由于Cu(OH)2 CuO+H2O↑中各物质的系数之比等于物质的量之比,则参加反应的氢氧化铜的物质的量为x/18mol;由于Cu(OH)2的式量为98,m=n?M,则参加反应的氢氧化铜的质量为98x/18g;由于沉淀样品质量为wg,则沉淀中氢氧化铜的质量分数为
CuO+H2O↑中各物质的系数之比等于物质的量之比,则参加反应的氢氧化铜的物质的量为x/18mol;由于Cu(OH)2的式量为98,m=n?M,则参加反应的氢氧化铜的质量为98x/18g;由于沉淀样品质量为wg,则沉淀中氢氧化铜的质量分数为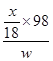 ×100%=
×100%=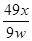 ×100%。
×100%。
考点:考查探究实验和化学计算,涉及提出假设、离子方程式、解释原因、整套装置连接顺序、设计实验方案、物质的量在化学方程式中的应用等。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案工业上用铁屑还原法制备碘化钠的主要流程如下图: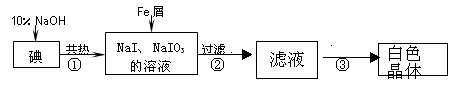
(1)碘元素位于周期表中第 周期,第 族;
(2)反应①的化学方程式 ;
(3)判断反应①中碘是否已完全反应的操作是 ;
(4)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,采取的措施最好是 ;
(5)某同推测步骤③中得到的白色晶体是NaI、NaIO3和NaOH的混合物,设计如下方案进行检验,实验结果表明其推测正确。
已知:IO3-十5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。
限选试剂:lmol/LH2SO4,2mol/LHNO3、淀粉溶液、酚酞试液、石蕊试液、蒸馏水。其它仪器和用品自选。
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 |  |
| 取少量溶液液于试管A中, . | 溶液显蓝色 | 溶液中含IO3一 |
| 另取少量溶液液于试管B中, . | . | 溶液中含大量0H一 |
要得到更纯的NaI,还需进一步的操作是 (填操作名称)
三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由 .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg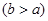 ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择: A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
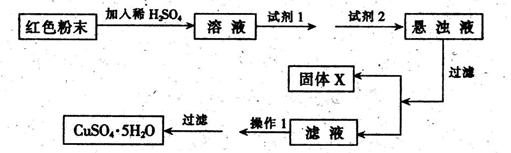
试回答:①试剂1为___ _,试剂2为 (填字母)。
②固体X的化学式为____,③操作I为_ 。
下列与生活相关的叙述错误的是
| A.酸性臭氧水(AOW)可用于消灭HlNl病毒,因为臭氧具有强氧化性 |
| B.水的处理常用到漂白粉和明矾,二者的作用原理相同 |
| C.二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成 |
| D.地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |