题目内容
【题目】H2S是二元弱酸,溶液中存在H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-。
H++S2-。
(1)向H2S溶液中加入CuSO4溶液时,电离平衡向_______移动,c(H+)________,c(S2-)________。
(2)向H2S溶液中加入NaOH固体时,电离平衡向_______移动,c(H+)________,c(S2-)________。
(3)若将H2S溶液加热至沸腾,c(H2S)________。
(4)若要增大H2S溶液中的c(S2-),最好加入__________。
【答案】右 增大 减小 右 减小 增大 减小 NaOH固体(合理即可)
【解析】
H2S是二元弱酸,其电离为可逆反应,若加入与其反应的物质,则破坏原来的平衡,导致平衡发生移动。
(1)加入CuSO4溶液时,则Cu2++ S2-=CuS↓不溶于酸,溶液中的c(S2-)减小,平衡向右移动,c(H+)增大,故答案为:右,增大,减小;(2)加入NaOH固体时,H++ OH-=H2O,c(H+)减小,平衡向右移动,c(S2-)增大,故答案为:右,减小,增大;(3)若将H2S溶液加热至沸腾,电离为吸热反应,升高温度平衡向电离的方向移动,同时H2S溶解度减小,气体逸出,c(H2S)减小,答案为减小;(4)若要增大H2S溶液中的c(S2-),使平衡右移,答案为NaOH固体或加热(不考虑气体逸出)。

练习册系列答案
相关题目
【题目】下列是典型晶体的结构示意图,从①到⑥对应正确的是:
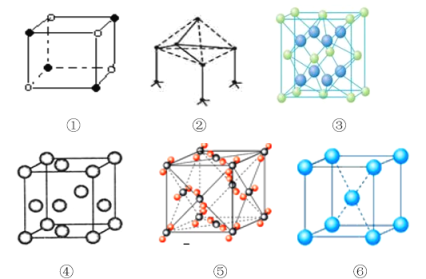
选项 | ① | ② | ③ | ④ | ⑤ | ⑥ |
A | NaCl | 单质硅 | CaF2 | Au | CO2 | K |
B | CaF2 | SiC | 金刚石 | Cu | CO2 | CsCl |
C | CsCl | 金刚石 | CaF2 | Cu | CO2 | Mg |
D | NaCl | BN | Au | CaF2 | CO2 | Na |
A. A B. B C. C D. D