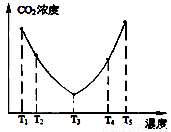题目内容
20.下列物质中和铜不发生反应的是( )| A. | 稀硝酸 | B. | 浓硝酸 | C. | 浓硫酸 | D. | 稀硫酸 |
分析 稀硝酸、浓硝酸和浓硫酸都具有极强的氧化性能与铜发生氧化还原反应,而稀硫酸是弱氧化性的酸与铜不能反应,由此分析解答.
解答 解;A、铜与稀硝酸反应生成硝酸铜和一氧化氮气体,故A不选;
B、铜与浓硝酸反应生成硝酸铜和二氧化氮气体,故B不选;
C、铜与浓硫酸反应生成硫酸铜和一氧化硫气体,故C不选;
D、铜与稀硫酸不能发生置换反应,故D选;
故选D.
点评 本题考查元素化合物的知识,学生要注意硝酸是强氧化性的酸,而浓硫酸具有强氧化性、稀硫酸不具有氧化性,比较容易.

练习册系列答案
相关题目
10.下列叙述不正确的是( )
| A. | 0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 在NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO-)+c(H2CO3) |
11.下列有关实验操作或叙述错误的是( )
| A. | 实验室常用如图所示的装置制取少量的乙酸乙酯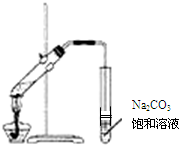 | |
| B. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤的速度 | |
| D. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的上端倒出 |
8.下列不能使品红溶液褪色的物质是( )
| A. | 氯水 | B. | 二氧化硫 | C. | 氯化钠溶液 | D. | 漂白粉溶液 |
5.在2L的容器里有某反应物4mol,反应进行2秒后,该反应物还剩3.2mol,则该反应的平均速率为( )(mol•L-1•s-1)
| A. | 0.1 | B. | 0.2 | C. | 0.4 | D. | 0.8 |
 CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.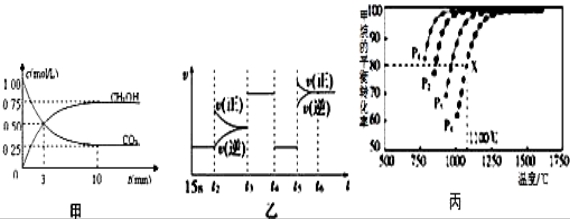
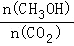 增大的是___________.
增大的是___________. 条件是_____________.(填序号)
条件是_____________.(填序号) J?mol—1
J?mol—1 的一个课题,污染分为空气污染,水污染,土壤污染等。
的一个课题,污染分为空气污染,水污染,土壤污染等。 ,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图
,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图