题目内容
【题目】甲醇是一种重要的可再生能源.
(1)2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a kJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=b kJ/mol
写出由CH4和O2制取CH3OH(g)的热化学方程式: .
(2)甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)= . 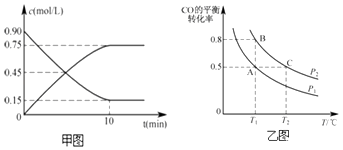
(3)在一容积可变的密闭容器中充入10mol CO和20mol H2 , 发生上述反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如乙图所示.
能判断该反应达到化学平衡状态的是(填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
(4)以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若KOH溶液足量,写出燃料电池负极的电极反应式:
(5)如图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为 . 当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为g. 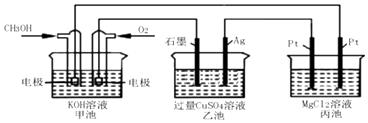
【答案】
(1)2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol
(2)0.15mol/(L?min)
(3)BD
(4)CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
(5)2Cu2++2H2O ![]() 2Cu+O2+4H+;34.8
2Cu+O2+4H+;34.8
【解析】解:(1)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,
所以答案是:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b) kJ/mol;(2)用甲醇表示的反应速率v= ![]() =0.075mol/(Lmin),氢气表示的反应速率是甲醇的2倍,即0.15mol/(Lmin),
=0.075mol/(Lmin),氢气表示的反应速率是甲醇的2倍,即0.15mol/(Lmin),
所以答案是:0.15 mol/(Lmin);(3)A.H2的消耗速率等于CH3OH的生成速率的2倍,不能说明正逆反应速率相等,不一定平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.反应的方程式为CO(g)+2H2(g)=CH3OH(g),充入10mol CO和20mol H2 , 消耗的反应物的物质的量为1:2,则无论是否达到平衡状态,H2的转化率和CO的转化率都相等,故C错误;
D.体系中气体的平均摩尔质量等于质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均摩尔质量不再改变,证明达到了平衡,故D正确.
所以答案是:BD;(4)碱性条件下,甲醇在负极被氧化生成碳酸根离子,电极方程式为CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O,所以答案是:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;(5)图2中甲池为原电池,通入甲醇的电极为负极,铜氧气的电极为正极,则乙池中石墨为阳极,银为阴极,溶液中铜离子在银电极析出,Cu2++2e﹣=Cu,阳极上是氢氧根离子放电生成氧气,所以电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑,电池反应的离子方程式为:2Cu2++2H2O ![]() 2Cu+O2+4H+ , 丙中与银连接的Pt电极为阳极,另一个电极为阴极,电极反应为阳极:2Cl﹣﹣2e﹣=Cl2↑,阴极为2H++2e﹣=H2↑,MgCl2+2H2O
2Cu+O2+4H+ , 丙中与银连接的Pt电极为阳极,另一个电极为阴极,电极反应为阳极:2Cl﹣﹣2e﹣=Cl2↑,阴极为2H++2e﹣=H2↑,MgCl2+2H2O ![]() Mg(OH)2↓+H2↑+Cl2↑,甲池中发生的反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,溶液中甲醇和氧气反应后导致溶液质量增大,每反应2mol甲醇和3mol氧气反应溶液质量增加=2mol×32g/mol+3mol×32g/mol=160g,电子转移为12mol,当甲池中增重16g时,电子转移1.2mol,电子守恒得到丙池中理论上产生沉淀为氢氧化镁,依据化学方程式,生成1mol氢氧化镁,电子转移2mol电子,则电子转移1.2mol,生成沉淀氢氧化镁0.6mol,计算得到物质的量为质量=0.6mol×58g/mol=34.8g,
Mg(OH)2↓+H2↑+Cl2↑,甲池中发生的反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,溶液中甲醇和氧气反应后导致溶液质量增大,每反应2mol甲醇和3mol氧气反应溶液质量增加=2mol×32g/mol+3mol×32g/mol=160g,电子转移为12mol,当甲池中增重16g时,电子转移1.2mol,电子守恒得到丙池中理论上产生沉淀为氢氧化镁,依据化学方程式,生成1mol氢氧化镁,电子转移2mol电子,则电子转移1.2mol,生成沉淀氢氧化镁0.6mol,计算得到物质的量为质量=0.6mol×58g/mol=34.8g,
所以答案是:2Cu2++2H2O ![]() 2Cu+O2+4H+;34.8.
2Cu+O2+4H+;34.8.
【考点精析】解答此题的关键在于理解化学平衡状态的判断的相关知识,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g),部分数据见下表(表中t2>t1):
反应时间/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)= ![]() mol?L﹣1?min﹣1
mol?L﹣1?min﹣1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时n(C02)=0.20 mol