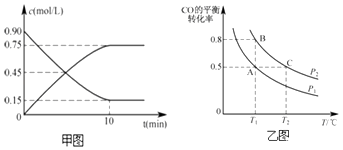
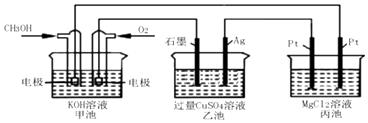
题目内容
【题目】氮化镁(Mg3N2)是工业上常用的脱硫剂.为了测定ag Mg3N2样品中Mg3N2的纯度,某同学设计了如图装置(样品中的杂质不与水反应,夹持装置已略去). 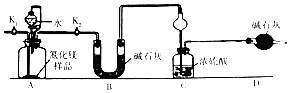
(1)装置A中发生反应的化学方程式为
(2)装置C中球形干燥管的作用是
(3)组装好实验装置后,首先应 , 再加入实验药品,打开(填“K1”或“K2”,后同),关闭 , 打开分液漏斗活塞,加入水,至不再产生气体.打开所有止水夹后通入氮气一段时间,测量装置(填“B”“C”或“D”)反应前后的质量变化为bg,通入氮气的目的是;
(4)Mg3N2的纯度是(用含a、b的式子表示)
(5)若去掉装置D,则导致测定结果(填“偏高”、“偏低”或“无影响”)
【答案】
(1)Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓
(2)防倒吸
(3)检验装置气密性;K2;K1;C;把装置中残留的氨气全部赶入C装置
(4)![]()
(5)偏高
【解析】解:A中氮化镁和水反应生成氨气和氢氧化镁,B干燥氨气,氨气极易溶于浓硫酸,易产生倒吸现象,D干燥空气,防止空气中水蒸气被浓硫酸吸收,(1)氮化镁和水反应生成氨气和氢氧化镁,反应方程式为Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓,所以答案是:Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓;(2)导致的干燥管有缓冲作用,所以能防倒吸,所以答案是:防倒吸;(3)有连接的仪器在使用前必须检验装置气密性,所以该实验在使用前必须检验装置气密性;打开K2关闭 K1 , 打开分液漏斗使氮化镁和水反应生成氨气,打开所有止水夹后通入氮气一段时间,将生成的氨气完全被浓硫酸吸收,浓硫酸增加的质量等于氨气质量,要测定氮化镁纯度应该知道氨气质量,所以需要测定C装置质量,所以通入氮气的目的是把装置中残留的氨气全部赶入C装置,所以答案是:检验装置气密性; K2; K1;C;把装置中残留的氨气全部赶入C装置;(4)根据N原子守恒得Mg3N2~2NH3 , 氮化镁纯度= ![]() =
= 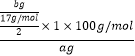 ×100%=
×100%= ![]() ,
,
所以答案是: ![]() ;(5)若去掉装置D,则导致空气中水蒸气被浓硫酸吸收,部分水蒸气被当作氨气,所以测定结果偏高,
;(5)若去掉装置D,则导致空气中水蒸气被浓硫酸吸收,部分水蒸气被当作氨气,所以测定结果偏高,
所以答案是:偏高.

【题目】某非金属X的最低负价为﹣m.它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的分子式为( )
A.H2b﹣8+mXOb
B.H2b﹣m+8XOb
C.H2b﹣8﹣mXOb
D.H2b+8+mXOb
【题目】如表各组物质中,不能通过一步反应实现如图所示转化的是( )
选项 | X | Y | Z |
A | Fe | FeCl3 | FeCl2 |
B | NH4Cl | NH3 | NO |
C | C | CO | CO2 |
D | Al2O3 | AlCl3 | Al(OH)3 |

A.A
B.B
C.C
D.D