题目内容
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如图所示。
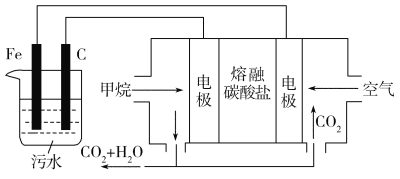
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4
b.CH3CH2OH
c.Na2SO4
d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e- = O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_______________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①负极的电极反应式为__________________________________________;
②正极的电极反应式为__________________________________________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)_____L。
【答案】c Fe-2e-===Fe2+ 4Fe2++10H2O+O2===4Fe(OH)3↓+8H+或4Fe2++4H++O2===4Fe3++2H2O,Fe3++3OH-===Fe(OH)3↓ CH4+4CO32--8e-===5CO2+2H2O O2+2CO2+4e-===2CO32-(或2O2+4CO2+8e-===4CO32-) 11.2
【解析】
(1)能使导电能力增强的电解质必须是易溶于水的,且只能是中性的;
(2)活泼金属电极做电解池的阳极,则电极本身放电;
(3)二价铁离子具有还原性,能被氧气氧化到正三价;
(4)①燃料电池中,正极发生的反应一定是氧气得电子的过程;
②电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳;
(5)在燃料电池和电解池的串联电路中,转移的电子数目是相同的。
(1)保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入的使导电能力增强的电解质必须是不污染水体的物质,故答案为:c。
(2)活泼金属电极做电解池的阳极,则电极本身放电,电极方程式为:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+。
(3)二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+或4Fe2++4H++O2=4Fe3++2H2O,Fe3++3OH-=Fe(OH)3↓,故答案为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,或4Fe2++4H++O2=4Fe3++2H2O,Fe3++3OH-=Fe(OH)3↓。
(4)①熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,CH4燃烧的产物是CO2和H2O,所以负极的电极方程式为:CH4+4CO32--8e-=5CO2+2H2O,故答案为:CH4+4CO32--8e-=5CO2+2H2O。
②燃料电池中,正极反应一定是氧气的电子的过程,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32-(或2O2+4CO2+8e-=4CO32-),故答案为:O2+2CO2+4e-=2CO32-(或2O2+4CO2+8e-=4CO32-)。
(5)阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当转移4mol电子时,消耗CH40.5mol,其在标准状况下的体积V=nVm=0.5mol×22.4L/mol=11.2L,故答案为:11.2L。

 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案