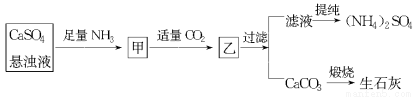
题目内容
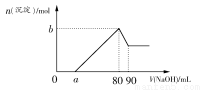
将一定质量的Mg、Al合金投入2.0 mol/L、250 mL的稀硫酸中,金属全部溶解。然后向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
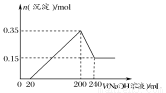
A.当加入NaOH溶液的体积为20 mL时,溶液的pH等于7
B.当加入NaOH溶液的体积为20 mL时,溶液中的溶质只有硫酸镁和硫酸铝
C.生成的H2在标准状况下的体积为11.2 L
D.所加NaOH溶液的物质的量浓度为5.0 mol/L
D
【解析】加入NaOH溶液的体积为20 mL时,得到Na2SO4、MgSO4、Al2(SO4)3的混合溶液,溶液显酸性,A错,B错;当沉淀量最大时,NaOH与H2SO4的关系为n(NaOH)=2n(H2SO4),故c(NaOH)=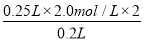 =5.0 mol/L,D对;根据Mg、Al与硫酸的反应,产生的n(H2)=
=5.0 mol/L,D对;根据Mg、Al与硫酸的反应,产生的n(H2)= n(Al)+n(Mg)=
n(Al)+n(Mg)=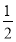 [3n(Al)+2n(Mg)]=
[3n(Al)+2n(Mg)]=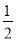 [3n(Al3+)+2n(Mg2+)],而NaOH溶液的体积为20~200 mL时,n(OH-)=3n(Al3+)+2n(Mg2+),故氢气的体积为
[3n(Al3+)+2n(Mg2+)],而NaOH溶液的体积为20~200 mL时,n(OH-)=3n(Al3+)+2n(Mg2+),故氢气的体积为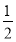 ×0.18 L×5.0 mol/L×22.4 L/mol=10.08 L,C错。
×0.18 L×5.0 mol/L×22.4 L/mol=10.08 L,C错。

练习册系列答案
相关题目