题目内容
【题目】烟气(主要污染物SO2、NOx)是大气主要污染物,有效去除大气中的SO2、NOx是环境保护的重要课题。
(1) 用天然碱生产小苏打的母液(主要溶质为碳酸钠)吸收烟气中SO2的相关反应的热化学方程式如下:
2Na2CO3(aq)+SO2(g)+H2O(l)===Na2SO3(aq)+2NaHCO3(aq)ΔH=a kJ·mol-1
2NaHCO3(aq)+SO2(g)===Na2SO3(aq)+2CO2(g)+H2O(l)ΔH=b kJ·mol-1
Na2SO3(aq)+SO2(g)+H2O(l)===2NaHSO3(aq)ΔH=c kJ·mol-1
反应Na2CO3(aq)+SO2(g)===Na2SO3(aq)+CO2(g)的ΔH=________kJ·mol-1。
(2) 用碳酸钠溶液吸收NO2的过程会产生NaNO2和NaNO3,写出相关化学反应方程式:__________________________________________________。
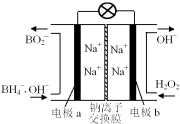
(3) 工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图所示,写出电解时铁电极发生的电极反应式:__________________________。随后,铁电极附近有无色气体产生,写出有关反应的离子方程式:__________________________________________。

(4) 工业上以钛基氧化物涂层材料为阳极、碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使NO3-变为NH4+。电极(电催化剂)所处的环境对其催化活性和选择性均起到重要作用。
①其他条件不变,向其中一份电解液中投加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低。可能原因是______________________________________________。
②其他条件不变,只改变溶液的pH,NO3-去除率如图所示,pH升高时,去除率________,可能原因是______________________________________。

【答案】(a+b)/2 Na2CO3+2NO2===NaNO2+NaNO3+CO2 Fe-2e-===Fe2+ 2NO2-+8H++6Fe2+===N2↑+6Fe3++4H2O 水中的氯离子在阳极上被氧化成氯气(或游离氯),与铵离子发生氧化反应,生成N2,从而使铵离子从水溶液中得到去除 降低 随着pH的升高,催化剂的催化活性明显下降(催化剂表面吸附的物质种类不同,酸碱度影响催化剂的活性)
【解析】
综合运用盖斯定律、电解原理、催化知识、化学反应中的守恒原理等,解决去除大气中的SO2、NOx的相关问题。
(1)由已知
2Na2CO3(aq)+SO2(g)+H2O(l)===Na2SO3(aq)+2NaHCO3(aq) ΔH=a kJ·mol-1
2NaHCO3(aq)+SO2(g)===Na2SO3(aq)+2CO2(g)+H2O(l) ΔH=b kJ·mol-1
两式相加得
2Na2CO3(aq)+2SO2(g)=2Na2SO3(aq)+2CO2(g) ΔH=(a+b)kJ·mol-1
故Na2CO3(aq)+SO2(g)===Na2SO3(aq)+CO2(g) ΔH=(a+b)/2kJ·mol-1。
(2)NO2溶于水呈酸性,用碳酸钠溶液吸收NO2产生NaNO2和NaNO3,同时会生成CO2,化学反应方程式Na2CO3+2NO2=NaNO2+NaNO3+CO2。
(3)由电解池中阳离子移动方向可知铁为阳极,电极反应为Fe-2e-=Fe2+;酸性溶液中,阳极生成的Fe2+将NO2-还原为N2,离子方程式2NO2-+8H++6Fe2+=N2↑+6Fe3++4H2O。
(4)①电解液含NaCl时,阳极会生成氯气,氯气将NH4+氧化为N2从溶液中逸出,使溶液中氮元素含量显著降低。
②从图中看,当反应时间相同时,pH越大,NO3-去除率越低。可能是pH影响催化剂的活性,pH升高使催化活性下降。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
电解质 | 醋酸 | 碳酸 | 亚硫酸 |
电离常数 | K=1.75×10-5 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.00×10-2 K2=1.02×10-7 |
(1)写出亚硫酸的第一级电离平衡常数表达式:K1=_____________________。
(2)已知NaHSO3溶液显酸性,写出溶液中离子浓度大小_____________________。
(3)Na2CO3溶液去油污的原因: _____________________。(用化学用语表示)
(4)在相同条件下,试比较①CH3COONa ②NaHCO3 ③Na2SO3水溶液的碱性强弱:(填序号)_____________________。
(5)若保持温度不变,在醋酸溶液中加入少量醋酸钠,下列量会变小的是_________。(填序号)
A.c(CH3COO-) B.c(H+) C.醋酸电离平衡常数 D.醋酸的电离程度
(6)NaHSO3水解反应的平衡常数Kb=_______________ molL-1。
(7)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________________。