题目内容
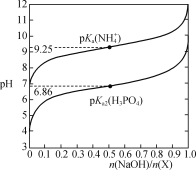
【题目】室温下,用NaOH溶液滴定X(NaH2PO4或NH4Cl)的稀溶液,溶液pH与n(NaOH)/n(X)的关系如图所示,已知:pKa=-lgKa,H2PO![]() +PO
+PO![]()
![]() 2HPO
2HPO![]() 。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol·L-1NH4Cl溶液中滴加氨水至溶液呈中性:c(Cl-)=c(NH![]() )>c(NH3·H2O)
)>c(NH3·H2O)
B.0.1mol·L-1NaH2PO4溶液中滴加NaOH至溶液呈中性:c(Na+)>3c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
C.0.1mol·L-1NaH2PO4溶液中滴加K3PO4至溶液呈中性:c(K+)>c(Na+)
D.0.1mol·L-1NaH2PO4溶液中滴加氨水至溶液呈中性:c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )>2c(NH
)>2c(NH![]() )+2c(NH3·H2O)
)+2c(NH3·H2O)
【答案】AC
【解析】
溶液中性时,有![]() ,当
,当![]() 时,溶液呈碱性(pH=9.25);当
时,溶液呈碱性(pH=9.25);当![]() 时,溶液呈酸性(pH=6.86)。
时,溶液呈酸性(pH=6.86)。
A.0.1mol·L-1NH4Cl溶液中,由电荷守恒得:![]() ,溶液呈中性,即有
,溶液呈中性,即有![]() ,故
,故![]() 。
。![]() 水解显酸性,
水解显酸性,![]() 电离显碱性,由图像可知,
电离显碱性,由图像可知,![]() 时,即
时,即![]() 与
与![]() 为1:1时,溶液呈碱性(pH=9.25),故溶液中性时
为1:1时,溶液呈碱性(pH=9.25),故溶液中性时![]() ,A正确;
,A正确;
B.0.1mol·L-1NaH2PO4溶液中,由电荷守恒得:c(Na+)+c(H+)=![]() +
+![]() +
+![]() +c(OH-),溶液呈中性,即有
+c(OH-),溶液呈中性,即有![]() ,故c(Na+)=
,故c(Na+)=![]() +
+![]() +
+![]() ,图像可知,当
,图像可知,当![]() 时,即
时,即![]() 与
与![]() 为1:1时,溶液呈酸性(pH=6.86),若溶液呈中性,
为1:1时,溶液呈酸性(pH=6.86),若溶液呈中性,![]() 的量需要稍大,即有c(Na+)<3c(HP
的量需要稍大,即有c(Na+)<3c(HP![]() )+3c(P
)+3c(P![]() ),B错误;
),B错误;
C.当NaH2PO4与K3PO4为3:1时,溶液中![]() ,由于H2PO
,由于H2PO![]() +PO
+PO![]()
![]() 2HPO
2HPO![]() ,此时溶液中
,此时溶液中![]() 与
与![]() 为1:1,由图像可知,此时的溶液呈酸性(pH=6.86),若溶液呈中性,K3PO4的量需稍微大一点,故c(K+)>c(Na+),C正确;
为1:1,由图像可知,此时的溶液呈酸性(pH=6.86),若溶液呈中性,K3PO4的量需稍微大一点,故c(K+)>c(Na+),C正确;
D.当NaH2PO4与氨水为1:2时,由物料守恒得c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )=2c(NH
)=2c(NH![]() )+2c(NH3·H2O) ,由图像可知
)+2c(NH3·H2O) ,由图像可知![]() ,所以
,所以![]() ,故
,故![]() 的酸性强于
的酸性强于![]() 的碱性,那么
的碱性,那么![]() 的酸性更强于
的酸性更强于![]() 的碱性,故
的碱性,故![]() 为酸性。NaH2PO4与氨水为1:2时,溶质为
为酸性。NaH2PO4与氨水为1:2时,溶质为![]() ,所以加的碱需要稍微多一点才能是中性,故c(H3PO4)+c(H2PO
,所以加的碱需要稍微多一点才能是中性,故c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )<2c(NH
)<2c(NH![]() )+2c(NH3·H2O),D错误;
)+2c(NH3·H2O),D错误;
故选AC。