题目内容
【题目】将一定量的镁与100 mL 18.5 mol/L浓硫酸充分反应后,镁完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+) = 0.1 mol/L,则下列叙述中错误的是
A. 反应中共转移电子3 mol B. 反应中共消耗镁 36 g
C. 气体A中SO2与H2的体积比为3:1 D. 气体A为SO2和H2的混合物
【答案】C
【解析】
生成气体的物质的量为:![]() =1.5mol,溶液稀释至1L,测得溶液的c(H+) = 0.1 mol/L,所以溶液剩余硫酸的物质的量为0.05mol,参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
=1.5mol,溶液稀释至1L,测得溶液的c(H+) = 0.1 mol/L,所以溶液剩余硫酸的物质的量为0.05mol,参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
Mg+ 2H2SO4(浓)=MgSO4+SO2↑+H2O
x2xx
Mg+H2SO4(稀)=MgSO4+H2↑
y yy
x+y=1.5 ① 2x+y=1.8 ② 由①②联立可得x=0.3,y=1.2
所以反应会生成0.3mol的二氧化硫和1.2mol的氢气。
A.反应转移电子数可根据气体来算,1mol气体生成转移2mol电子,反应中共转移电子1.5mol×2=3mol,故不选A;
B.反应中共消耗镁 1.5mol×24g/mol=36 g,故不选B;
C.气体A中SO2与H2的体积比等于物质的量之比为0.3:1.2=1:4,故选C。
D.气体A为SO2和H2的混合物,故不选D。
正确答案:C。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后并回答下列问题:
成分 | 质量/g | 摩尔质量/(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是__________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)__________________(只要求写表达式,不需计算)mol·L-1。
(3)下图所示的仪器中,在配制“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的玻璃仪器有__________________(填仪器名称)。
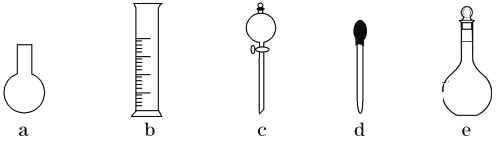
(4)配制过程中,下列操作对配制结果没有影响的是__________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中要含有__________。(填化学符号)