��Ŀ����
��15�֣��������[aFe2(SO4) 3��b(NH4) 2SO4��cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȡ�ij����������������������������ƣ��������Ϊԭ�ϣ���������¹���������ȡ������李�
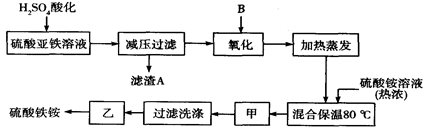
��ش��������⣺
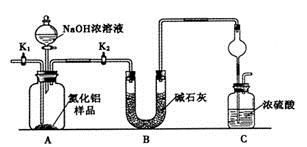
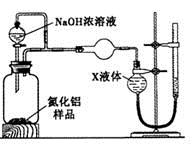
��1������������Һ��H2SO4�ữ����ҪĿ����____________________________������A����Ҫ�ɷ���__________________��
��2���������������ʺϵ�������B�� ����Ӧ�����ӷ���ʽ ��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
��3�������ס��ҵ����Ʒֱ��ǣ���______________����___________________��
��4�����������У����������ʺϵ�������B����֮��ͼ�������֮ǰ����ȡ��������Fe2+�Ƿ���ȫ���������������Լ�Ϊ ��д���ƣ����ܷ������Ե�KMnO4��Һ�� ������ܣ����ʺ��ԣ��������ǣ� �����������ֻ�ʽ˵����
��5���������������NH4+�ķ����� ��
��6����ȡ14.00 g������Ʒ����������ˮ���Ƴ�100 mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14 g����������һ����Һ�м���0.05 mol Ba (NO3)2��Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ______________________��

��ش��������⣺
��1������������Һ��H2SO4�ữ����ҪĿ����____________________________������A����Ҫ�ɷ���__________________��
��2���������������ʺϵ�������B�� ����Ӧ�����ӷ���ʽ ��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
��3�������ס��ҵ����Ʒֱ��ǣ���______________����___________________��
��4�����������У����������ʺϵ�������B����֮��ͼ�������֮ǰ����ȡ��������Fe2+�Ƿ���ȫ���������������Լ�Ϊ ��д���ƣ����ܷ������Ե�KMnO4��Һ�� ������ܣ����ʺ��ԣ��������ǣ� �����������ֻ�ʽ˵����
��5���������������NH4+�ķ����� ��
��6����ȡ14.00 g������Ʒ����������ˮ���Ƴ�100 mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14 g����������һ����Һ�м���0.05 mol Ba (NO3)2��Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ______________________��
��1��������Һ��SO42-Ũ�ȣ���Ca2+ת��Ϊ������ͬʱ����Fe2+�� Fe3+ˮ�⣻CaSO4.
��2��b;H2O2��2Fe2+��2H+��2Fe2+��2H2O
��3����ȴ�ᾧ����������
��4�����軯����Һ�����ܣ���Ϊ��������Ͷ��������Ӿ���ʹ���Ը��������Һ��ɫ
��5�����Թ��м���������Ʒ���������ƹ�����ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ���飬������ֽ�����ɫ����6��Fe2(SO4)3��2(NH4)2SO4��2H2O
�����������1��������Һ��SO42-Ũ�ȣ���Ca2+ת��Ϊ������ͬʱ����Fe2+�� Fe3+ˮ�⣻CaSO4.
��2��b����ɫ��������������Լ����������µ����ʣ�H2O2��2Fe2+��2H+��2Fe2+��2H2O
��3����ȴ�ᾧ����������
��4���������������Ӧ��ʹ�û�ɫ�����軯��K3��Fe(CN)6����Һ����������������������ӷ�Ӧ���ɴ���������ɫ�����軯����������3Fe2+��2��Fe(CN)6��3-��Fe3��Fe(CN)6��2�������ܣ���Ϊ��������Ͷ��������Ӿ���ʹ���Ը��������Һ��ɫ
��5�����Թ��м���������Ʒ���������ƹ�����ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ���飬������ֽ�����ɫ����֤��ԭ��Һ�к��а������ӡ�
��6��14.00 g������Ʒ�У������������Ƶõ�2.14 g����Ϊ��������������
n(Fe)��
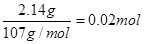
 ����һ����Һ�м���0.05 mol Ba (NO3)2��Һ��ǡ����ȫ��Ӧ�������ᱵ�����������Һ�е����������Ϊ0.05 mol ��Ҳ�������к��е�Fe2(SO4)3Ϊ0.01 mol��(NH4)2SO4Ϊ0.02 mol ����ʱ����Ϊ��0.01 mol ��400g/mol��0.02 mol ��132g/mol��6.64g��ʣ�µľ���H2O����������ôÿһ����Һ��ˮ������Ϊ��7.00g��6.64g��0.36g,n(H2O)��0.02 mol����˸�������淋Ļ�ѧʽΪ��Fe2(SO4)3��2(NH4)2SO4��2H2O
����һ����Һ�м���0.05 mol Ba (NO3)2��Һ��ǡ����ȫ��Ӧ�������ᱵ�����������Һ�е����������Ϊ0.05 mol ��Ҳ�������к��е�Fe2(SO4)3Ϊ0.01 mol��(NH4)2SO4Ϊ0.02 mol ����ʱ����Ϊ��0.01 mol ��400g/mol��0.02 mol ��132g/mol��6.64g��ʣ�µľ���H2O����������ôÿһ����Һ��ˮ������Ϊ��7.00g��6.64g��0.36g,n(H2O)��0.02 mol����˸�������淋Ļ�ѧʽΪ��Fe2(SO4)3��2(NH4)2SO4��2H2O
��ϰ��ϵ�д�
 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д� Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
�����Ŀ

 NH2COONH4(s) ��H��0
NH2COONH4(s) ��H��0