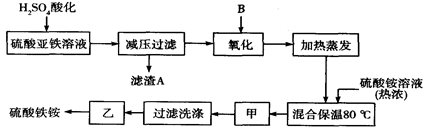
题目内容
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 操 作 | 现 象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴加KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3氧化,形成致密的氧化膜 |
| C | 向某溶液中滴加浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| D | 向紫色石蕊试液中通入SO2 | 溶液褪色 | SO2有漂白性 |
C
试题分析:A、过量的Fe粉中加入稀HNO3,充分反应后,滴加KSCN溶液,溶液不变红色,稀HNO3先将Fe氧化为Fe3+,过量的铁与Fe3+反应生成Fe2+,错误;B、稀硝酸不能使Al箔钝化,错误;C、向某溶液中滴加浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口,试纸变蓝,该溶液中存在NH4+,正确;D、二氧化硫不能使酸碱指示剂褪色,向紫色石蕊试液中通入SO2,溶液变红色,证明二氧化硫溶于水呈酸性,错误。

练习册系列答案
相关题目