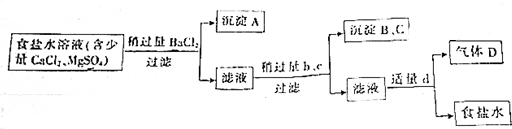
题目内容
12.雾霾含有大量的污染物SO2、NO.工业上还可变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如图1(Ce为铈元素):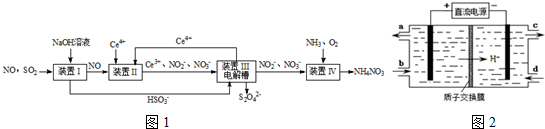
(1)装置Ⅰ中的主要离子方程式为SO2+OH-=HSO3-.
(2)写出装置Ⅱ中,酸性条件下(假设NO反应后全部转化成NO2-)的离子方程式NO+H2O+Ce4+=Ce3++NO2-+2H+.
(3)装置Ⅲ还可以使Ce4+再生,其原理如图2所示.生成Ce4+从电解槽的a(填字母序号)口流出.写出阴极的电极反应式2HSO3-+4H++4e-=S2O32-+3H2O.
分析 (1)二氧化硫是酸性氧化物,能和强碱之间发生反应;
(2)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(3)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应.
解答 解:(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应
,故答案为:SO2+OH-=HSO3-;
(2)在酸性环境下,NO和Ce4+之间会发生氧化还原反应,反应的离子方程式为:NO+H2O+Ce4+=Ce3++NO2-+2H+,
故答案为:NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;
(3)在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上极a极流出;
电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3-+4H++4e-=S2O32-+3H2O,
故答案为:a;2HSO3-+4H++4e-=S2O32-+3H2O.
点评 本题考查离子方程式书写、电解原理及其应用,题目难度中等,注意知识的梳理和归纳是关键,注意掌握电解原理、离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.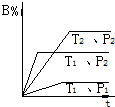 已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )
已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )
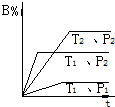 已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )
已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )| A. | T1<T2,P1>P2,m+n>P,△H>0 | B. | T1>T2,P2>P1,m+n<P,△H>0 | ||
| C. | T2>T1,P2>P1,m+n<P,△H>0 | D. | T1>T2,P2>P1,m+n>P,△H<0 |
20.下列说法正确的是( )
| A. | 用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-═37Cl-+3Cl2↑+3H2O | |
| B. | 在溶液中等物质的量的FeBr2与Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积均匀混合 AlO2-+H++H2O═Al(OH)3↓ | |
| D. | 0.1mol/L的Na2CO3溶液中2 C(Na+)═C (HCO3-)+C (H2CO3)+C(CO32-) |
17.W、X、Y、Z均为短周期元素,W、X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构,W和Z的最外层电子数相同.下列说法正确的是( )
| A. | W、X的最高价氧化物对应水化物的酸性:X>W | |
| B. | 单质沸点:Y>Z>W | |
| C. | 离子半径:X->W->Y+>Z- | |
| D. | 结合质子能力:X2->W- |
13.某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出.

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.竖直冷凝管接通冷凝水,进水口是Ⅱ(填“I”或“Ⅱ”);冷凝回流的主要目的是充分反应,提高反应物的转化率.
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是石蕊试液(或AgNO3溶液)和溴水(或酸性KMnO4溶液),写出C装置中主要的化学方程式:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3 .
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
请你补充下列实验步骤,直到分离出1-溴丁烷.
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭a,打开b;
④接通冷凝管的冷凝水,使冷水从d处流入;
⑤迅速升高温度至101.6℃,收集所得馏分.
(4)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.(保留2位有效数字)

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.竖直冷凝管接通冷凝水,进水口是Ⅱ(填“I”或“Ⅱ”);冷凝回流的主要目的是充分反应,提高反应物的转化率.
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是石蕊试液(或AgNO3溶液)和溴水(或酸性KMnO4溶液),写出C装置中主要的化学方程式:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3 .
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭a,打开b;
④接通冷凝管的冷凝水,使冷水从d处流入;
⑤迅速升高温度至101.6℃,收集所得馏分.
(4)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.(保留2位有效数字)
14.在反应8NH3+3Cl2=6NH4Cl+N2中,若有10.2g NH3被氧化,则反应用去的氯气在标准状况下体积为( )
| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |