题目内容
5.(1)难溶电解质在水溶液中存在着电离平衡,已知Cu(OH)2的Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,应调节溶液的pH值,使之大于5.(2)实验室用铅蓄电池做电源电解饱和食盐水制氯气,已知电池放电时发生如下反应:
负极:Pb+SO42--2e-═PbSO4 正极:PbO2+4H++SO42--2e-═PbSO4+2H2O
今制得0.05mol氯气,则电池中消耗硫酸的物质的量是0.1mol
(3)某温度(t0C)时,水的KW=10-13,则该温度(填“大于”“小于”或“等于”)大于250C,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,若所得混合液为中性,则a:b=10:1.
(4)常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)>c(C O32-),(填“>”、“=”或“<”)原因是溶液中存在HCO3-+H2O?H2CO3+OH-,HCO3-?CO32-+H+,HCO3-水解程度大于其电离程度(用离子方程式和必要的文字说明).
分析 (1)利用溶度积常数计算溶液中氢氧根离子浓度,即c(OH-)=$\sqrt{\frac{Ksp}{c(C{u}^{2+})}}$,再根据水的离子积常数计算氢离子浓度,氢离子浓度的负对数的值就是溶液的pH值;
(2)根据电解过程中电荷守恒找出氯气和硫酸的关系式,根据氯气计算硫酸的消耗量;
(3)水的电离的过程是吸热的,温度越高,水的离子积越大;溶液呈中性,说明氢离子的物质的量 等于氢氧根离子的物质的量;
(4)0.1mol•L-1NaHCO3 溶液的pH大于8,溶液显碱性,HCO3-的水解程度大于其电离程度.
解答 解:(1)已知Cu(OH)2的Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol/L,若生成沉淀,则溶液中即c(OH-)=$\sqrt{\frac{Ksp}{c(C{u}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$=1×10-9 mol/L,C(H+)=$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5 mol/L,所以溶液的pH=5,
故答案为:5;
(2)设生成0.050mol氯气需转移的电子为xmol.
2Cl--2e-=Cl2↑
2mol 1mol
x 0.050mol
解得x=0.1mol,
设消耗硫酸的物质的量为ymol,
放电时,铅蓄电池的电池反应式为:
PbO2+Pb+2H2SO4=2PbSO4+2H2O 转移电子
2mol 2mol
y 0.1mol
y=0.1
所以消耗硫酸 0.1mol.
故答案为:0.1mol;
(3)水的电离的过程是吸热的,温度越高,水的离子积越大,某温度(t℃)时,水的KW=10-13>10-14,所以温度高于室温,
若所得混合溶液为中性,说明氢离子的物质的量等于氢氧根离子的物质的量,pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则0.01mol/L×aL=0.1mol/L×bL,a:b=10:1,
故答案为:大于;10:1;
(4)0.1mol•L-1NaHCO3 溶液的pH大于8,溶液显碱性,HCO3-的水解程度大于其电离程度,水解反应:HCO3-+H2O?H2CO3+OH-,水解生成H2CO3,电离方程式:HCO3-?CO32-+H+,电离生成CO3 2-,则c(H2CO3)>c(CO3 2-),
故答案为:>;溶液中存在HCO3-+H2O?H2CO3+OH-,HCO3-?CO32-+H+,HCO3-水解程度大于其电离程度.
点评 本题考查溶度积的计算、电解原理的应用、pH的简单计算和水的离子积的影响因素、盐的水解原理等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,注意酸、碱溶液中,氢氧根浓度和氢离子浓度的计算方法.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案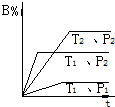 已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )
已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )| A. | T1<T2,P1>P2,m+n>P,△H>0 | B. | T1>T2,P2>P1,m+n<P,△H>0 | ||
| C. | T2>T1,P2>P1,m+n<P,△H>0 | D. | T1>T2,P2>P1,m+n>P,△H<0 |

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.竖直冷凝管接通冷凝水,进水口是Ⅱ(填“I”或“Ⅱ”);冷凝回流的主要目的是充分反应,提高反应物的转化率.
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是石蕊试液(或AgNO3溶液)和溴水(或酸性KMnO4溶液),写出C装置中主要的化学方程式:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3 .
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭a,打开b;
④接通冷凝管的冷凝水,使冷水从d处流入;
⑤迅速升高温度至101.6℃,收集所得馏分.
(4)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.(保留2位有效数字)
| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
| A. | 金刚石的熔沸点高、硬度大 | B. | 通常情况下,Br2的沸点比I2的低 | ||
| C. | 氯化钠的水溶液具有导电性 | D. | 水电解生成氢气和氧气 |

