题目内容
7.稀硫酸和碳酸钠都是无色溶液,若无其他试剂,可以采取互相滴定的方式加以区分.实验内容及记录如下:①量取1.00mL甲溶液,向其中缓慢滴入乙溶液10.0mL,共收集到1.344mL气体.
②量取10.00mL乙溶液,向其中缓慢滴入甲溶液1.00mL,共收集到0.448mL气体.
回答下列问题:
(1)甲是H2SO4溶液,乙是Na2CO3溶液(填写化学式);
(2)结合离子方程式说明判断的理由:根据反应H++CO32-=HCO3-、H++HCO3-=H2O+CO2↑,才能产生CO2气体,实验①产生的气体多于②,说明实验①反应后溶液里不存在HCO3-,H+完全转化为CO2气体逸出;;
(3)甲溶液的物质的量浓度为0.06mol/L,乙溶液的物质的量浓度为0.01mol/L;
(4)向12.00mL乙溶液中缓慢滴入甲溶液,画出产生CO2的体积随滴入甲溶液体积的变化关系图.
分析 稀硫酸和碳酸钠溶液正反滴加时反应原理和现象不一样,可以不用试剂鉴别,具体操作是:(Ⅰ)稀硫酸滴加到碳酸溶液里,依次发生的离子反应是:H++CO32-=HCO3-、H++HCO3-=H2O+CO2↑,现象是最初无气体,然后有气泡;(Ⅱ)将碳酸钠溶液滴加到稀硫酸中,因酸过量,开始就有气泡出现,发生的离子反应是2H++CO32-=H2O+CO2↑;如果硫酸足量这两情况生成的二氧化碳应该是一样多,现①量取1.00mL甲溶液,向其中缓慢滴入乙溶液10.0mL,共收集到1.344mL气体.②量取10.00mL乙溶液,向其中缓慢滴入甲溶液1.00mL,共收集到0.448mL气体,两种情况生成的二氧化碳不一样多,说明酸不足,碳酸钠过量,由此可知②是将稀硫酸滴入碳酸钠溶液里,生成的CO2量较少,据此分析解题;
(1)因①②两种情况生成的二氧化碳不一样多,故硫酸的量不足量,碳酸钠过量,由此可知②是将稀硫酸滴入碳酸钠溶液里,生成的CO2量较少;
(2)碳酸钠溶液里的CO32-遇H+,依次发生的离子反应是H++CO32-=HCO3-、H++HCO3-=H2O+CO2↑,只有酸过量才能生成更多的CO2;
(3)实验①说明酸中的H+全部与CO32-反应生成CO2,发生的离子反应为2H++CO32-=H2O+CO2↑,根据CO2的物质的量可以计算出硫酸的物质的量浓度,实验②依次发生反应H++CO32-=HCO3-、H++HCO3-=H2O+CO2↑,可结合硫酸溶液里的H+和生成CO2的物质的量求算碳酸钠的物质的量,再计算浓度;
(4)向碳酸钠溶液里缓慢滴加稀硫酸,发生的反应为H++CO32-=HCO3-、H++HCO3-=H2O+CO2↑,故可根据12mL碳酸溶液里碳酸根离子的物质的量可计算出二次消耗的硫酸各多少mL,再画出关系图.
解答 解:(1)当向硫酸中加入Na2CO3溶液时,发生反应2H++CO32-=CO2↑+H2O,硫酸酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入硫酸时,先发生反应CO32-+H+=HCO3-,当所有CO32-均转化为HCO3-时,再发生反应HCO3-+H+=CO2↑+H2O,由实验①②中数据可知等量的甲与等量的乙反应,实验①产生的CO2气体多,说明甲为H2SO4、乙为Na2CO3,
故答案为:H2SO4;Na2CO3;
(2)CO32-与H+先后发生两个反应:H++CO32-=HCO3-、H++HCO3-=H2O+CO2↑,才能产生CO2气体,实验①产生的气体多于②,说明实验①反应后溶液里不存在HCO3-,H+完全转化为CO2气体逸出,故答案为:根据反应H++CO32-=HCO3-、H++HCO3-=H2O+CO2↑,才能产生CO2气体,实验①产生的气体多于②,说明实验①反应后溶液里不存在HCO3-,H+完全转化为CO2气体逸出;
(3)实验①生成CO2的物质的量为1.344×10-3L÷22.4L/mol=0.6×10-4mol,根据2H++CO32-=CO2↑+H2O,硫酸溶液里H+的物质的是为0.6×10-4mol×2=1.2×10-4mol,硫酸的物质的量为1.2×10-4mol÷2=0.6×10-4mol,硫酸的物质的量浓度为0.6×10-4mol÷0.001L=0.06mol/L;实验②生成的CO2的物质的量为0.448×10-3L÷22.4L/mol=0.2×10-4mol,假设乙溶液里碳酸钠的物质的是来nmol,根据依次发生的反应:H++CO32-=HCO3-、H++HCO3-=H2O+CO2↑,则这两个反应中消耗的H+等于硫酸溶液里H+的物质的量,故nmol+0.2×10-4mol=1.2×10-4mol,解得n=1.0×10-4mol,故碳酸溶液的物质的量浓度为1.0×10-4mol÷0.01L=0.01mol/L,故答案为:0.06mol/L;0.01mol/L;
(4)12.00mL碳酸钠溶液里碳酸钠的物质的量为12.00×10-3L×0.01mol/L=0.12×10-3mol,根据依次发生的离子反应:H++CO32-=HCO3-、H++HCO3-=H2O+CO2↑,可知两次消耗的硫酸的体积相同,均为:0.12×10-3mol÷(0.06mol/L×2)=0.001L=1.00mL,根据碳原子守恒,生成CO2的物质的量于碳酸钠的物质的量相等,体积为0.12×10-3mol×22.4L/mol=2.688×10-3L=2.688mL,据此可作出产生CO2的体积随滴入甲溶液体积的变化关系图为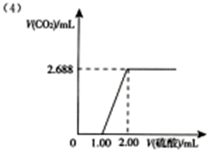 ,故答案为:
,故答案为: .
.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,注意把握反应的离子方程式或化学方程式,根据方程式结合质量守恒计算该题,题目难度中等

 阅读快车系列答案
阅读快车系列答案| A. | 中和pH和体积均相同的盐酸和醋酸溶液,消耗相同浓度的NaOH的体积较多的是醋酸 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液蒸干、灼烧都得到Fe2O3 | |
| C. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
| A. | 实验室制取Cl2时,可用饱和Na2CO3溶液除去其中的HCl | |
| B. | 新制氯水需放在棕色试剂瓶中 | |
| C. | 漂白粉漂白时,向溶液中滴入少量的盐酸,漂白效果会增强 | |
| D. | 向石蕊溶液中通入氯气,溶液先变红后褪色 |
| A. | CH4(g)+2O2(g)═CO2(g)+2 H2O(g )△H=-890kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2 H2O(l )△H=+890kJ/mol | |
| C. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(1)△H=-445kJ/mol | |
| D. | CH4(g)+2O2(g)═CO2(g)+2 H2O(l )△H=-890kJ |
| A. | 经常用钢丝球擦洗铝锅表面,可以防止铝锅被腐蚀 | |
| B. | 埋在地下的钢铁管道每隔一段距离就连结一定数量的铜块 | |
| C. | 供应热水的水龙头使用陶瓷制品代替钢铁制品 | |
| D. | 洗衣机的滚筒采用不锈钢材料,既耐磨又耐腐蚀 |
| A. | HCl | B. | NaOH | C. | CuSO4 | D. | KNO3 |
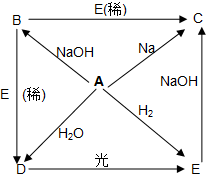 已知A、B、C、D、E五种物质都含有相同的元素X,这五种物质间相互转化关系如下:
已知A、B、C、D、E五种物质都含有相同的元素X,这五种物质间相互转化关系如下: 2,4,4-三甲基己烷,
2,4,4-三甲基己烷,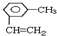 .
.