题目内容
5.下列物质分类正确的是( )| A. | HCl、纯碱、硫酸钡均为强电解质 | |
| B. | SO2、SiO2、CO均为酸性氧化物 | |
| C. | 稀豆浆、油水、氯化铁溶液均为胶体 | |
| D. | 大理石、CuSO4•5H2O、氨水均为混合物 |
分析 A、酸碱盐都是电解质,水溶液中全部电离的化合物为强电解质;
B、和碱反应生成盐和水的化合物为酸性氧化物;
C、油水属于浊液、氯化铁溶液是溶液,不属于胶体;
D、硫酸铜晶体为化合物.
解答 解:A、酸碱盐都是电解质,HCl、纯碱、硫酸钡在水溶液中全部电离的化合物为强电解质,故A正确;
B、和碱反应生成盐和水的化合物为酸性氧化物,CO不能反应属于不成盐氧化物,故B错误;
C、油水属于浊液、氯化铁溶液是溶液,不属于胶体,稀豆浆属于胶体,故C错误;
D、大理石主要成分是碳酸钙为混合物、硫酸铜晶体为化合物、氨水是氨气的水溶液属于混合物,故D错误;
故选A.
点评 本题考查了物质分类方法,物质组成的分析判断注意物质组成和名称的分析应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
20.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(7)小题用元素符号或化学式回答,(8)~(9)小题按题目要求回答.
(1)这九种元素分别为AHBNaCAlDCENFPGFHClINe.
(2)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的是F.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G、H形成的化合物中,最稳定的HF.
(5)在B、C、E、F、G、H中,原子半径最大的是Na.
(6)A和D组成最简单化合物的电子式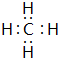 .
.
(7)A和E组成化合物的化学式NH3等.
(8)用电子式表示B和H组成化合物的形成过程 .
.
(9)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的是F.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G、H形成的化合物中,最稳定的HF.
(5)在B、C、E、F、G、H中,原子半径最大的是Na.
(6)A和D组成最简单化合物的电子式
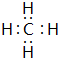 .
.(7)A和E组成化合物的化学式NH3等.
(8)用电子式表示B和H组成化合物的形成过程
 .
.(9)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
10.对标准状况下的四种气体的关系从小到大表示不正确的是( )
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3.
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3.
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
17.有NO、CO2、NO2三种气体,它们分别都含有0.5mol氧原子,同温同压下三种气体的体积之比为( )
| A. | 1:2:3 | B. | 2:1:1 | C. | 4:2:1 | D. | 1:2:4 |
15.下列有关物质性质的说法错误的是( )
| A. | 铁、铝在常温下都能被浓硫酸“钝化” | |
| B. | 足量铝分别与含1molHCl、l mol NaOH的溶液反应,产生相同量的氢气 | |
| C. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| D. | 浓硫酸与铜反应既体现了其强氧化性又体现了其酸性 |