题目内容
(18分)
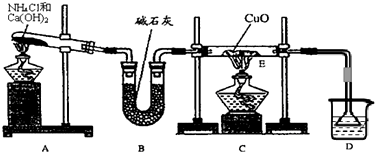
Ⅰ. 氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。
请回答:
(1)实验室制取氨气的化学方程式是 。
(2)① 如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。
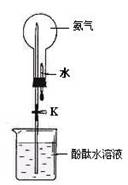
② 氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
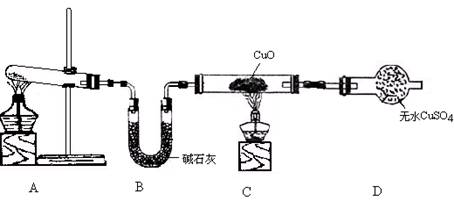
① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
② 碱石灰的作用是 。
③ 整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称)。

Ⅱ. 3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为 mol。
②所生成的NO在标准状况下体积为 L。(以上结果均用含a的代数式表示)
Ⅲ. 某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料知道:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:
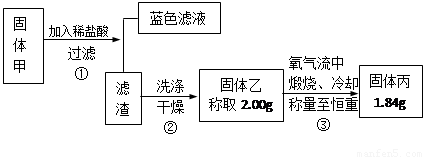
(1)③中在煅烧过程中一定发生的反应的化学方程式为 。
(2)关于固体甲的成分的判断中,下列说法正确的是
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S。
Ⅰ.(1)2NH4Cl
+ Ca(OH)2 CaCl2
+ 2NH3↑+2H2O
CaCl2
+ 2NH3↑+2H2O
(2)①轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K。
②NH3
+ H2O NH3·H2O
NH3·H2O NH4+
+ OH-
NH4+
+ OH-
(3)① 3CuO
+ 2NH3 3Cu
+ N2 + 3H2O
3Cu
+ N2 + 3H2O
② 吸收氨气中有的水蒸气,防止干扰产物水的测定。
③ 如图所示:(合理即给分)。
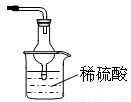
最好是下层CCl4上层H2O,导管通到CCl4中
Ⅱ. ①(a+0.1)mol ② 11.2(a-0.04) L
Ⅲ(1)CuS+3O2
 2SO2+2CuO (条件:高温或煅烧都可)
2SO2+2CuO (条件:高温或煅烧都可)
(2) BCD
【解析】
试题分析:I. (1)实验室用加热氯化铵和氢氧化钙的混合物制取氨气,反应方程式为2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+2H2O。
CaCl2 + 2NH3↑+2H2O。
(2)①要产生喷泉现象,可使烧瓶中压强减小。挤压胶头滴管,使少量水进入烧瓶,氨气极易溶于水,使烧瓶中压强减小,然后打开止水夹K,即可看到喷泉现象。
②氨气溶于水形成氨水,氨水显碱性,能使酚酞试液变红,原理为NH3
+ H2O 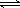 NH3·H2O
NH3·H2O
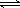 NH4+ + OH- 。
NH4+ + OH- 。
(3)①黑色氧化铜变为红色,红色固体为Cu,白色无水硫酸铜变为蓝色,说明生成了H2O,反应中CuO作氧化剂,NH3作还原剂,N化合价升高,所以生成的无色气体为N2。反应方程式为3CuO + 2NH3 3Cu + N2 + 3H2O。
3Cu + N2 + 3H2O。
②碱石灰作用是干燥氨气,防止干扰水的检验。
③本实验尾气中含有NH3,NH3排放到空气中会污染环境,所以应将其除去,考虑到NH3在水中溶解度很大,所以不能把氨气直接通入水中,应采用防倒吸装置。
II. ①Cu与过量稀硝酸反应后溶液中溶质有硝酸铜和过量的硝酸,根据电荷守恒n(H+)+2n(Cu2+)=n(NO3-),其中n(Cu2+)=n(Cu)=0.05mol,n(NO3-)=(a+0.1)mol。
②设生成NO和NO2物质的量分别为xmol、ymol。由得失电子相等得:3x+y=2n(Cu),由N守恒得:x+y+(a+0.1)mol=0.03×8mol。解得x=(0.5a-0.02)mol
III.固体甲加入稀盐酸后,得到蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种。滤渣可能为Cu、CuS、Cu2S,考察反应方程式:2Cu + O2
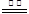 2 CuO(固体质量增加);Cu2S+2O2
2 CuO(固体质量增加);Cu2S+2O2
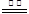 2CuO+2SO2 (固体质量不变);2CuS+3O2
2CuO+2SO2 (固体质量不变);2CuS+3O2 2CuO+2SO2 (固体质量减小)。题中固体乙生成固体丙质量减小,说明固体乙中一定有CuS【③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O2
2CuO+2SO2 (固体质量减小)。题中固体乙生成固体丙质量减小,说明固体乙中一定有CuS【③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O2 2CuO+2SO2 】。若2g乙全是CuS,则生成CuO1.67g,而题中固体乙为1.84g,说明固体乙中除了CuS,还有其他物质。
2CuO+2SO2 】。若2g乙全是CuS,则生成CuO1.67g,而题中固体乙为1.84g,说明固体乙中除了CuS,还有其他物质。
固体乙可能的情况有:①CuS+CuO;②CuS+Cu2S;③CuS+CuO+Cu2S。
所以固体甲中一定有CuS,固体甲中若有Cu2O,Cu2S可有可无;若无Cu2O,则一定有Cu2S。
由以上分析可知,对于固体甲的成分的判断,正确的是B、C、D。
考点:化学实验 化学计算
点评:本题拓展了教材中的典型实验,测重基本实验操作能力考查。化学计算注重解题技巧,尤其是最后一题考查思维的深刻性和灵活性。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案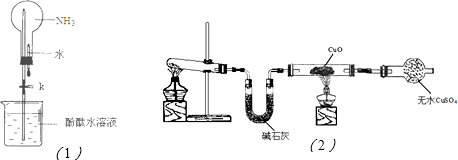
 ;
;