题目内容
(2010?顺义区一模)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质.请回答:
(1)实验室制取氨气的化学方程式是
(2)①如图(1)是进行氨气喷泉实验的装置,引发喷泉的操作步骤是
②氨气使烧杯中溶液由无色变为红色,其原因是
(3)该小组同学设计了如图(2)所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物.
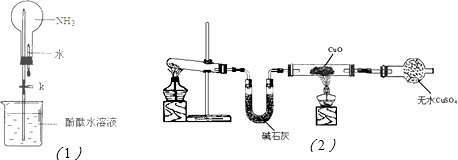
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
②碱石灰的作用是
③该装置存在明显缺陷,请指出存在的问题并提出改进意见
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+
Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O.
(5)工业废气中的氮氧化物是主要的大气污染物之一.为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2.现有NO2和NO的混合气体3.0L,跟3.4L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是
(1)实验室制取氨气的化学方程式是
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(2)①如图(1)是进行氨气喷泉实验的装置,引发喷泉的操作步骤是
轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K
轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K
.②氨气使烧杯中溶液由无色变为红色,其原因是
NH3+H2O?NH3?H2O?NH4++OH-
NH3+H2O?NH3?H2O?NH4++OH-
(用电离方程式表示).(3)该小组同学设计了如图(2)所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物.

①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
3CuO+2NH3
3Cu+N2+3H2O
| ||
3CuO+2NH3
3Cu+N2+3H2O
.
| ||
②碱石灰的作用是
吸收氨气中混有的水蒸气,防止干扰产物水的测定
吸收氨气中混有的水蒸气,防止干扰产物水的测定
.③该装置存在明显缺陷,请指出存在的问题并提出改进意见
此装置无有尾气吸收装置,NH3排入大气,污染环境;连接一个吸收氨气装置如图所示: ;
;
 ;
;此装置无有尾气吸收装置,NH3排入大气,污染环境;连接一个吸收氨气装置如图所示: ;
;
. ;
;(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+
| H+ |
取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O反之则没有
取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O反之则没有
;(5)工业废气中的氮氧化物是主要的大气污染物之一.为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2.现有NO2和NO的混合气体3.0L,跟3.4L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是
7:3
7:3
.分析:(1)实验室用氯化铵和氢氧化钙加热制取氨气;棉花有防止空气对流的作用;
(2)①氨气是极易溶于水的气体,使烧瓶内产生压强差导致溶液进入烧瓶;
②氨气易溶于水生成氨水,氨水是弱电解质电离出氢氧根离子;
(3)①先根据实验现象判断生成物,再根据元素守恒写出反应方程式;
②碱石灰是干燥剂;
③根据氨气的性质分析判断;
(4)根据在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+
Cu+Cu2+)进行实验设计;
(5)先根据方程式计算X值,再利用十字相乘法计算二氧化氮和一氧化氮的体积比.
(2)①氨气是极易溶于水的气体,使烧瓶内产生压强差导致溶液进入烧瓶;
②氨气易溶于水生成氨水,氨水是弱电解质电离出氢氧根离子;
(3)①先根据实验现象判断生成物,再根据元素守恒写出反应方程式;
②碱石灰是干燥剂;
③根据氨气的性质分析判断;
(4)根据在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+
| H+ |
(5)先根据方程式计算X值,再利用十字相乘法计算二氧化氮和一氧化氮的体积比.
解答:解:(1)在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、水和氨气,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)①NH3极易溶解于水,打开止水夹挤出胶头滴管中的水,然后打开止水夹K,由于氨气迅速溶解导致烧瓶内气体压强迅速减小,导致溶液进入烧瓶产生喷泉现象,
故答案为:轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K;
②氨气和水反应生成氨水,氨水能电离出铵根离子和氢氧根离子,导致溶液呈碱性,酚酞试液遇碱变红色,
故答案为:NH3+H2O?NH3?H2O?NH4++OH-;
(3)①黑色CuO变为红色,所以生成物是铜;白色无水CuSO4粉末变为蓝色,说明生成物含有水;同时生成一种无色气体,该气体无污染,所以该气体是氮气,
故答案为:3CuO+2NH3
3Cu+N2+3H2O;
②碱石灰是干燥剂能吸收水蒸气,,防止干扰产物水的测定,故答案为:吸收氨气中混有的水蒸气,防止干扰产物水的测定;
③氨气是刺激性气体,所以不能排空,应有尾气处理装置,故答案为:此装置无有尾气吸收装置,NH3排入大气,污染环境;
连接一个吸收氨气装置如图所示: ;
;
(4)在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+
Cu+Cu2+)进行实验设计,向溶液中加入酸溶液,如果溶液呈现蓝色,说明说明红色物质中含有Cu2O反之则没有,
故答案为:取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O反之则没有;
(5)3NOx+2xNH3=
N2+3xH2O,
3 2x
3.0L 3.4L
所以x=1.7
故氮氧化物的分子式为NO1.7,根据氮氧化物的平均化学式计算NO2与NO的体积比,
 ,所以二氧化氮和一氧化氮的体积比为11.2:4.8=7:3,
,所以二氧化氮和一氧化氮的体积比为11.2:4.8=7:3,
故答案为:7:3.
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)①NH3极易溶解于水,打开止水夹挤出胶头滴管中的水,然后打开止水夹K,由于氨气迅速溶解导致烧瓶内气体压强迅速减小,导致溶液进入烧瓶产生喷泉现象,
故答案为:轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K;
②氨气和水反应生成氨水,氨水能电离出铵根离子和氢氧根离子,导致溶液呈碱性,酚酞试液遇碱变红色,
故答案为:NH3+H2O?NH3?H2O?NH4++OH-;
(3)①黑色CuO变为红色,所以生成物是铜;白色无水CuSO4粉末变为蓝色,说明生成物含有水;同时生成一种无色气体,该气体无污染,所以该气体是氮气,
故答案为:3CuO+2NH3
| ||
②碱石灰是干燥剂能吸收水蒸气,,防止干扰产物水的测定,故答案为:吸收氨气中混有的水蒸气,防止干扰产物水的测定;
③氨气是刺激性气体,所以不能排空,应有尾气处理装置,故答案为:此装置无有尾气吸收装置,NH3排入大气,污染环境;
连接一个吸收氨气装置如图所示:
 ;
;(4)在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+
| H+ |
故答案为:取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O反之则没有;
(5)3NOx+2xNH3=
| 3+2x |
| 2 |
3 2x
3.0L 3.4L
所以x=1.7
故氮氧化物的分子式为NO1.7,根据氮氧化物的平均化学式计算NO2与NO的体积比,
 ,所以二氧化氮和一氧化氮的体积比为11.2:4.8=7:3,
,所以二氧化氮和一氧化氮的体积比为11.2:4.8=7:3,故答案为:7:3.
点评:本题考查了氨气的性质和制取,难度不大,会根据题中信息设计实验,实验设计是高考的热点和难点.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目