题目内容
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料.为探究氨气的性质,某研究性学习小组做了以下实验: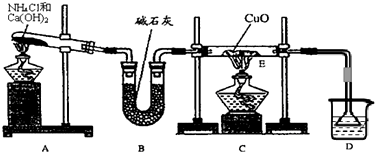
(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气.
①实验室制取氨气的化学方程式为
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O.已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+.
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2.
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O.(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体.下列有关说法正确的是【已知:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO↑+7H2O】
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L.
分析:(1)①固体氯化铵与氢氧化钙反应生成氯化钙、氨气、和水;
②碳酸氢铵分解除了生成氨气外还生成二氧化碳和水蒸气,要得到纯净干燥的氨气,可用B除去杂质二氧化碳和水蒸气;
(2)氨气通过加热的氧化铜,反应现象是黑色变化为红色,证明氧化铜被还原为铜,说明氨气具有还原性;
(3)依据Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+.如果含有Cu2O加入稀硫酸反应生成铜离子溶液显蓝色;
(4)依据方程式利用原子个数守恒计算解答.
②碳酸氢铵分解除了生成氨气外还生成二氧化碳和水蒸气,要得到纯净干燥的氨气,可用B除去杂质二氧化碳和水蒸气;
(2)氨气通过加热的氧化铜,反应现象是黑色变化为红色,证明氧化铜被还原为铜,说明氨气具有还原性;
(3)依据Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+.如果含有Cu2O加入稀硫酸反应生成铜离子溶液显蓝色;
(4)依据方程式利用原子个数守恒计算解答.
解答:解:(1)①固体氯化铵与氢氧化钙反应生的化学方程式:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O;
②碳酸氢铵分解除了生成氨气外还生成二氧化碳和水蒸气,要得到纯净干燥的氨气,可用B除去杂质二氧化碳和水蒸气;
(2)氨气通过C装置后,氧化铜由黑色变化为红色,证明氧化铜被还原为铜,可以证明氨气具有还原性;
故答案为:还原性;
(3)依据Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+.如果含有Cu2O加入稀硫酸反应生成铜离子溶液显蓝色,
故答案为:取少量样品粉末于试管中,滴加稀硫酸,如果溶液呈蓝色,则样品中含有Cu2O;
(4)解:设混合物中有xmolCu和ymolCu2O,根据方程式列式:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 8 3 2
x
x x
x
3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO↑+7H2O
3 14 6 2
y
y 2y
y
则生成NO的物质的量为:
x+
y=
=0.2mol;
又因为:Cu2++2OH-=Cu(OH)2↓ Cu(OH)2
CuO+2H2O
1 2 1 1mol 80g
x+2y 2(x+2y) x+2y x+2y 32.0g
怎产生沉淀的质量为:( x+2y )×80g/mol=32g;
将方程式联立:
x+
y=0.2
( x+2y )×80=32
解得:x=0.2(mol) y=0.1(mol)
A.加入的氢氧化钠的物质的量:1.0mol/L×V=x+2y=0.4mol,解得:V=0.4L,故A错误;
B.Cu和Cu2O混合物质量为:0.2mol×64g/mol+0.1mol×144g/mol=27.2g,故B正确;
C.依据氮原子个数守恒,混合物完全溶解溶液中氢离子的物质的量等于剩余硝酸的物质的量=0.4L×3.0mol/L-
=1.0mol,故C错误;
D.氧化亚铜被还原化学方程式为:Cu2O+H2
2Cu+H2O,消耗的氢气的物质的量等于Cu2O的物质的量等于0.1mol,标况下体积为:0.1mol/L×22.4L/mol=2.24L,故D错误;
故选B.
故答案为:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O;
②碳酸氢铵分解除了生成氨气外还生成二氧化碳和水蒸气,要得到纯净干燥的氨气,可用B除去杂质二氧化碳和水蒸气;
(2)氨气通过C装置后,氧化铜由黑色变化为红色,证明氧化铜被还原为铜,可以证明氨气具有还原性;
故答案为:还原性;
(3)依据Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+.如果含有Cu2O加入稀硫酸反应生成铜离子溶液显蓝色,
故答案为:取少量样品粉末于试管中,滴加稀硫酸,如果溶液呈蓝色,则样品中含有Cu2O;
(4)解:设混合物中有xmolCu和ymolCu2O,根据方程式列式:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 8 3 2
x
| 8 |
| 3 |
| 2 |
| 3 |
3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO↑+7H2O
3 14 6 2
y
| 14 |
| 3 |
| 2 |
| 3 |
则生成NO的物质的量为:
| 2 |
| 3 |
| 2 |
| 3 |
| 4.48L |
| /22.4L/mol |
又因为:Cu2++2OH-=Cu(OH)2↓ Cu(OH)2
| ||
1 2 1 1mol 80g
x+2y 2(x+2y) x+2y x+2y 32.0g
怎产生沉淀的质量为:( x+2y )×80g/mol=32g;
将方程式联立:
| 2 |
| 3 |
| 2 |
| 3 |
( x+2y )×80=32
解得:x=0.2(mol) y=0.1(mol)
A.加入的氢氧化钠的物质的量:1.0mol/L×V=x+2y=0.4mol,解得:V=0.4L,故A错误;
B.Cu和Cu2O混合物质量为:0.2mol×64g/mol+0.1mol×144g/mol=27.2g,故B正确;
C.依据氮原子个数守恒,混合物完全溶解溶液中氢离子的物质的量等于剩余硝酸的物质的量=0.4L×3.0mol/L-
| 4.48L |
| 22.4mol/L |
D.氧化亚铜被还原化学方程式为:Cu2O+H2
| ||
故选B.
点评:本题考查了氨气的制备和性质的检验,有关硝酸的计算,题目综合性强,难度中等,(4)题有关硝酸的计算是本题的难点,解题关键能够把握反应的实质,正确运用原子个数守恒定律,依据方程式列出相关量的关系式.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中,N2+3H2 2NH3△H<0
2NH3△H<0
①该反应的平衡常数K的表达式为:K=______.升高温度,K值______(填“增大”、“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3 )
表中数据,______℃______MPa时H2的转化率最高,实际工业生产不选用该条件的主要原因是______.
③下列关于合成氨说法正确是______
A、使用催化剂可以提高NH3的产率
B、寻找常温下的合适催化剂是未来研究的方向
C、由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式______,你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),其原因是______.
(1)传统哈伯法合成氨工艺中,N2+3H2
 2NH3△H<0
2NH3△H<0①该反应的平衡常数K的表达式为:K=______.升高温度,K值______(填“增大”、“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3 )
| 压强(Mpa) 氨的平衡含(%) 温度(摄氏度) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
③下列关于合成氨说法正确是______
A、使用催化剂可以提高NH3的产率
B、寻找常温下的合适催化剂是未来研究的方向
C、由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式______,你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),其原因是______.