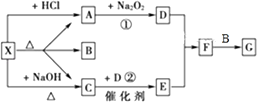
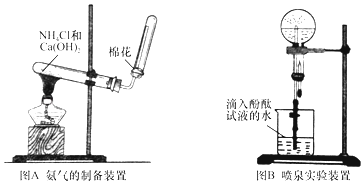
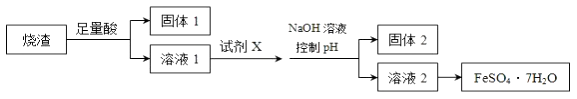
题目内容
【题目】在如图中,甲烧杯中盛有100mL 0.50molL﹣1 AgNO3溶液,乙烧杯中盛有100mL 0.25molL﹣1CuCl2溶液,A,B,C,D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则 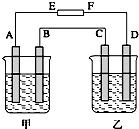
(1)电源E为极,F为极.
(2)A极的电极反应式为 , 析出物质mol.
(3)B极的电极反应式为 , 析出气体mL(标).
(4)C极的电极反应式为 , 析出的物质mol.
(5)D极的电极反应式为 , 析出气体mL(标况).
(6)甲烧杯中滴入石蕊试液,极附近变红,若继续电离,在甲烧杯中最终得到溶液.
【答案】
(1)负;正
(2)Ag++e﹣=Ag;0.025
(3)4OH﹣﹣4e﹣═H2O+O2↑;140
(4)Cu2++2e﹣=Cu;0.0125mol
(5)2Cl﹣﹣2e﹣=Cl2↑;280
(6)B;硝酸
【解析】解:(1)电解池中,发现A极比C极重1.9g,则A极是阴极,和电源的负极相连的是阴极,即E是负极,F是正极,B是阳极,C是阴极,D是阳极,所以答案是:负;正;(2)A极是阴极,电极反应式为:Ag++e﹣=Ag,C是阴极,电极反应为:Cu2++2e﹣=Cu,析出金属铜,A极比C极重1.9g,设电路转移电子是x,则108x﹣32x=1.9,所以x=0.025mol,析出金属银的物质的量是0.025mol,所以答案是:Ag++e﹣=Ag;0.025mol;(3)B是阳极,该极上是氢氧根离子失电子,电极反应为:4OH﹣﹣4e﹣═H2O+O2↑,电路转移电子0.025mol,生成氧气是0.00625mol,体积是0.00625mol×22.4L/mol=0.14L=140mL,所以答案是:4OH﹣﹣4e﹣═H2O+O2↑;140;(4)C是阴极,电极反应式为:Cu2++2e﹣=Cu,电路转移电子0.025mol,生成金属铜是0.0125mol,所以答案是:;0.0125mol;(5)D是阳极,该极上的电极反应是:2Cl﹣﹣2e﹣=Cl2↑,电路转移电子0.025mol,生成氯气是0.0125mol,体积是280mL,所以答案是:2Cl﹣﹣2e﹣=Cl2↑;280;(6)电解硝酸银,在阴极上是Ag++e﹣=Ag,阳极B上是:4OH﹣﹣4e﹣═H2O+O2↑,B电极附近产生硝酸,滴入石蕊试液,显示红色,所以答案是:B;硝酸.

 科学实验活动册系列答案
科学实验活动册系列答案