��Ŀ����
����Ŀ��ijͭ����Ҫ��Cu2��OH��2CO3 �� ��������Fe��Si�Ļ����ʵ�����Դ�ͭ��ʯΪԭ���Ʊ�CuSO45H2O��CaCO3 �� ���ֲ�����ͼ�� 
��ش��������⣺
��1����ҺA������Cu2+�⣬�����ܺ��еĽ����������������ӷ��ţ�����֤�����������õ��Լ����� ��
��2���������ɵ�CO2��ȡ����̼��ƣ��Ʊ�ʱ�������Ȼ�����Һ��ͨ�백������ͨ��CO2 ��
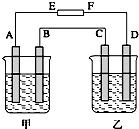
��ʵ����ͨ�����ü����Ȼ�狀��������ƻ����ķ�����ȡ������ijѧϰС��ѡȡͼ1��������װ����ȡ���ռ������İ�����
����������������Ӹ������ӿڣ�����Ϊ��ȷ��˳��Ϊa����������i��
������i����©���������� ��
��Ϊ̽�������������ķ�Ӧ��ͼ2��
a��װ��A��B��Bװ���ڵ�ҩƷ�������� ��
b��װ��C������̽�������백������֪�����Ͱ����ɷ�����Ӧ��3Cl2+2NH3=N2+6HCl���ķ�Ӧ��ʵ�����1��3���ر�2��������ƿ��ͨ�� �� Ȼ��ر�1��3����2������ƿ�л���ͨ��һ��������һ�����壮ʵ��һ��ʱ�������ƿ�ڳ���Ũ��İ��̲��������ڱ����ᣮ
��3���ⶨͭ��ʯ��Cu2��OH��2CO3�����ٷֺ����ķ����ǣ�
a����1.25gͭ��ʯ��ȡ��CuSO45H2O����ƿ�У���������ˮ��ȫ�ܽ⣻
b������Һ�м���100mL0.25mol/L������������ҺʹCu2+��ȫ������
c�����ˣ�
d����Һ�е�����������Һ��0.5mol/L����ζ����յ㣬����10mL���ᣮ��ͭ��ʯ��Cu2��OH��2CO3��������Ϊ ��
���𰸡�
��1��Fe2+��Fe3+�����Ը��������Һ��KSCN��Һ
��2��g��h��e��d����ֹ����������ʳ��ˮ��Ũ�������
��3��88.8%
���������⣺˫��ˮ����ǿ�����ԣ��ܰ����������������������ӣ���������ҺA�м���H2O2��Ӧ�����ӷ���ʽ��2Fe2++H2O2+2H+=2Fe3++2H2O����1��Cu2��OH��2CO3�Լ�Fe��Si�Ļ�������ϡ���ᷴӦ��������ͭ������������������������������ϡ�����Ӧ��������ҺA�г�����Cu2+�⣬�����ܺ��еĽ���������Fe2+��Fe3+ �� ��֤�����������õ��Լ��Ǹ��������Һ�����������ӣ������������Һ�����������γ�Ѫ��ɫ��Һ�����Դ��ǣ�Fe2+��Fe3+ �� ���Ը��������Һ��KSCN��Һ����2���ٸ���װ��ͼ��֪��Aװ�����Ʊ������ģ��������ɵİ����к���ˮ������������Ҫ���ѡ�ü�ʯ�Ҹ���������ܶ�С�ڿ����ģ��Ұ�����������ˮ������Ӧ���������ſ������ռ�������Ҫ������İ����������գ������ȷ�IJ���˳����a��g��h��e��d��i��������������ˮ�������i������©���������Ƿ�ֹ������
���Դ��ǣ�ghed����ֹ��������Ϊ̽�������������ķ�Ӧ��Ҫ��Aװ�����������Ƶõ������к����Ȼ����ˮ�����ʣ�Ҫ�ñ���ʳ��ˮ��Ũ�����ȥ������װ��B�е�ҩƷ�����DZ���ʳ��ˮ��Ũ���ᣬ����װ��C�Ľṹ��֪���ܶ�С������ӵ���2�����ܶȴ������ӵ���1������������������ܳ�ֽӴ������Թر�2��������ƿ��ͨ��������
���Դ��ǣ�����ʳ��ˮ��Ũ�����������3��������������ʵ�����0.01L��0.5mol/L=0.005mol������ݷ���ʽNaOH+HCl=NaCl+H2O��֪�������ᷴӦ������������0.005mol���������Ƶ����ʵ�����0.1L��0.25mol/L=0.025mol����������ͭ��Ӧ������������0.025mol��0.005mol=0.020mol������ݷ���ʽ2NaOH+CuSO4=Cu��OH��2��+Na2SO4��֪������ͭ�����ʵ�����0.020mol��2=0.010mol�����Ը���ԭ���غ��֪��ͭ��ʯ��Cu2��OH��2CO3�����ʵ�����0.010mol��2=0.005mol������Cu2��OH��2CO3��������Ϊ ![]() ��100%=88.8%��
��100%=88.8%��
���Դ��ǣ�88.8%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�