题目内容
【题目】NaHCO3 和 NaHSO4 溶液混合后,实际参加反应的离子是( )
A.CO32﹣ 和 H+B.HCO3﹣ 和HSO4﹣
C.CO32﹣ 和HSO4﹣D.HCO3﹣ 和 H+
【答案】D
【解析】
碳酸氢钠和硫酸氢钠反应时,碳酸氢根电离生成钠离子和碳酸氢根离子,硫酸氢钠电离生成钠离子和氢离子、硫酸根离子,碳酸氢根和氢离子反应生成水和二氧化碳,故答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
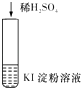
【题目】下列实验现象所对应的离子方程式不正确的是( )
实 验 | 现 象 | 离子方程式 | |
A |
| 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I﹣+O2═2I2+2H2O |
B |
| 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl﹣、 |
C |
| 溶液由黄绿色变为无色 | Cl2+2OH﹣═Cl﹣+ClO﹣+H2O |
D |
| 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH﹣+H++SO |
A.A
B.B
C.C
D.D