题目内容
5.下列说法正确的( )| A. | 水结冰后体积膨胀的原因是由于水分子内存在氢键造成的 | |
| B. | F2、Cl2、Br2、I2由于组成结构相似,相对分子质量逐渐增大,分子间作用力逐渐增大,所以熔沸点逐渐升高 | |
| C. | 根据元素周期表的知识判断51Sb是一种可以作为半导体材料的非金属元素 | |
| D. | 碳元素有多种核素,如12C、13C、14C、C60它们互为同位素 |
分析 A.冰中的氢键比液态水中的多,使得水分子排列更加有序;
B.卤素单质都是分子晶体,熔沸点的高低与分子间作用力的大小有关,而决定分子间作用力在因素是相对分子量的大小;
C.51Sb在周期表中,位置金属元素与非金属元素的交界线处;
D.质子数相同,中子数不同的原子互称同位素.
解答 解:A.冰中的氢键比液态水中的多,使得水分子排列更加有序,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,故A正确;
B.F2、Cl2、Br2、I2都是分子晶体,组成结构相似,相对分子质量逐渐增大,分子间作用力逐渐增大,所以熔沸点逐渐升高,故B正确;
C.51Sb在周期表中,位置金属元素与非金属元素的交界线处,具有半导体的性质,可以作半导体材料,但是Sb属于金属元素,故C错误;
D.C60属于单质,质子数相同,中子数不同的原子互称同位素,则12C、13C、14C互为同位素,故D错误.
故选AB.
点评 本题考查了氢键、分子间作用力对物质性质的影响,元素周期表、同位素,题目难度不大,注意氢键对物质物理的物理性质影响.

练习册系列答案
相关题目
15.下列物质在空气里完全燃烧,生成二氧化碳和水的物质的量之比为1:1,符合条件的是下列( )
| A. | 乙烯 | B. | 丙烯醛 | C. | 乙醇 | D. | 丁烷 |
16.下列说法正确的是( )
| A. | NA个H2SO4分子的总质量就是H2SO4的摩尔质量 | |
| B. | 将40 g烧碱溶于水得溶液甲,再向甲中通入1 mol HCl得溶液乙(假设过程中溶液体积不变),则在相同温度下,甲和乙的导电能力一样 | |
| C. | 1 L 0.1 mol/L HF溶液中含有的离子总数约为0.2 NA | |
| D. | 标况下22.4 L SO3溶解于水并稀释为1 L后,溶液中c(H+)=2 mol/L |
13.下列实验现象描述中错误的是( )
| A. | 红热的铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| B. | 将SO2气体通入澄清石灰水中,石灰水变浑浊,继续通入SO2,浑浊不消失 | |
| C. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
20.将质量相等的铁片和铜片插入氯化钠溶液中,铜片与电源的正极相连,铁片与电源的负极相连,以I=1A的恒定电流强度进行电解,下列有关说法正确的是( )
| A. | 阳极上产生能够使湿润淀粉碘化钾试纸变蓝的气体 | |
| B. | 电解一段时间后,电解池的温度升高10℃,此时铁片上析出气体的速率加快 | |
| C. | 电解时钠离子向铜片电极方向移动 | |
| D. | 电解一段时间后溶液中会出现蓝色沉淀,总反应为:Cu+2H2O通电_Cu(OH)2↓+H2↑ |
17.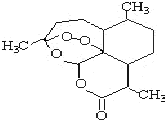 青蒿素是一种由青蒿中分离得到的具有新型化学结构的抗疟药,结构如图所示.有关该化合物的叙述正确的是( )
青蒿素是一种由青蒿中分离得到的具有新型化学结构的抗疟药,结构如图所示.有关该化合物的叙述正确的是( )
 青蒿素是一种由青蒿中分离得到的具有新型化学结构的抗疟药,结构如图所示.有关该化合物的叙述正确的是( )
青蒿素是一种由青蒿中分离得到的具有新型化学结构的抗疟药,结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H20O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 青蒿素与维生素一样是水溶性的 | |
| D. | 该化合物中含有过氧键,一定条件下有氧化性 |
14.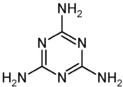 2008年9月11日,有媒体报道,甘肃14名婴儿患肾结石,省卫生厅介入调查,初步认为可能与某品牌奶粉有关.随后,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉收到三聚氰胺污染,并宣布召回市面上被污染的产品.质检总局,卫生部等有关部门随即展开调查.三聚氰胺的分子结构如图,有关三聚氰胺的说法正确的是( )
2008年9月11日,有媒体报道,甘肃14名婴儿患肾结石,省卫生厅介入调查,初步认为可能与某品牌奶粉有关.随后,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉收到三聚氰胺污染,并宣布召回市面上被污染的产品.质检总局,卫生部等有关部门随即展开调查.三聚氰胺的分子结构如图,有关三聚氰胺的说法正确的是( )
 2008年9月11日,有媒体报道,甘肃14名婴儿患肾结石,省卫生厅介入调查,初步认为可能与某品牌奶粉有关.随后,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉收到三聚氰胺污染,并宣布召回市面上被污染的产品.质检总局,卫生部等有关部门随即展开调查.三聚氰胺的分子结构如图,有关三聚氰胺的说法正确的是( )
2008年9月11日,有媒体报道,甘肃14名婴儿患肾结石,省卫生厅介入调查,初步认为可能与某品牌奶粉有关.随后,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉收到三聚氰胺污染,并宣布召回市面上被污染的产品.质检总局,卫生部等有关部门随即展开调查.三聚氰胺的分子结构如图,有关三聚氰胺的说法正确的是( )| A. | 三聚氰胺属于芳香族化合物,但不属于芳香烃 | |
| B. | 三聚氰胺的分子式为C3N6H6 | |
| C. | 三聚氰胺中的碳原子属于饱和碳原子 | |
| D. | 三聚氰胺分子中的所有原子都在一个平面内 |


 ;
; 、
、 .
.