题目内容
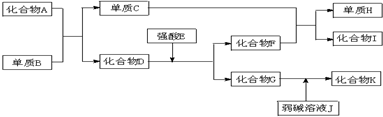
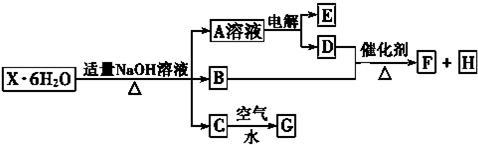
有一种复盐的结晶水合物X?6H2O,其水溶液为浅绿色,X中阴、阳离子个数比为2:3,经实验测定,其水溶液显酸性,可发生如下的转化.其中B、D、E、F均为无色气体且B的水溶液呈碱性,C、G为难溶于水的固体.在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀.
根据以上实验现象和有关信息,请回答下列问题:
(1)指出由C→G的现象是: ,发生反应的化学方程式为 .
(2)用惰性电极电解溶液A时得到D的电极反应式为 ,
(3)B与D反应生成F的化学方程式为 ,
(4)该晶体水合物的化学式为 .

根据以上实验现象和有关信息,请回答下列问题:
(1)指出由C→G的现象是:
(2)用惰性电极电解溶液A时得到D的电极反应式为
(3)B与D反应生成F的化学方程式为
(4)该晶体水合物的化学式为
考点:无机物的推断
专题:推断题
分析:X的水溶液为浅绿色,说明X含有Fe2+离子,碱性条件下生成碱性气体的B为NH3,C、G为难溶于水的固体,则C为Fe(OH)2,G为Fe(OH)3,在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明A中含有SO42-,电解A的溶液生成气体B、D,应是电解水,可推知A为Na2SO4,而D能与氨气反应,故D为O2,B为H2,则气体F为NO,H为H2O,由以上分析可知X中含有NH4+、Fe2+和SO42-,X中阴、阳离子个数比为2:3,故X为(NH4)2Fe(SO4)2?6H2O,据此解答.
解答:
解:X的水溶液为浅绿色,说明X含有Fe2+离子,碱性条件下生成碱性气体的B为NH3,C、G为难溶于水的固体,则C为Fe(OH)2,G为Fe(OH)3,在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明A中含有SO42-,电解A的溶液生成气体B、D,应是电解水,可推知A为Na2SO4,而D能与氨气反应,故D为O2,B为H2,则气体F为NO,H为H2O,由以上分析可知X中含有NH4+、Fe2+和SO42-,X中阴、阳离子个数比为2:3,故X为(NH4)2Fe(SO4)2?6H2O,
(1)由以上分析可知C→G的反应为氢氧化亚铁的氧化生成氢氧化铝,现象为:白色沉淀迅速变为灰绿色,最后变为红褐色,反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色沉淀迅速变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)用惰性电极电解溶液A时得到D的电极反应式为阳极上氢氧根离子放电发生氧化反应生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
(3)B与D反应生成F的反应为氨气的催化氧化,化学方程式为4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(4)由以上分析可知X为(NH4)2Fe(SO4)2?6H2O,故答案为:(NH4)2Fe(SO4)2?6H2O.
(1)由以上分析可知C→G的反应为氢氧化亚铁的氧化生成氢氧化铝,现象为:白色沉淀迅速变为灰绿色,最后变为红褐色,反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色沉淀迅速变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)用惰性电极电解溶液A时得到D的电极反应式为阳极上氢氧根离子放电发生氧化反应生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
(3)B与D反应生成F的反应为氨气的催化氧化,化学方程式为4NH3+5O2
| ||
| △ |
| ||
| △ |
(4)由以上分析可知X为(NH4)2Fe(SO4)2?6H2O,故答案为:(NH4)2Fe(SO4)2?6H2O.
点评:本题考查无机物的推断,侧重于学生的分析能力的考查,掌握元素化合物的性质是关键,注意根据物质的特性进行推断,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知葡萄糖(C6H12O6)的燃烧热是2804kJ?mol-1,当它被氧化生成1mol水时放出的热量是( )
| A、26.0kJ |
| B、51.9kJ |
| C、155.8kJ |
| D、467.3kJ |
把CO2通入NaOH的水溶液中,当它们完全反应时其质量比为11:15,则下列关于反应后的溶液的说法正确的是( )
| A、溶液只能与酸反应 |
| B、溶液只能与碱反应 |
| C、溶液中溶质的质量之比为1:1 |
| D、可继续吸收CO2 |
下列事实不能用勒夏特列原理解释的是( )
| A、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| B、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 |
| C、过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多 |
| D、久制的氯水PH值变小 |