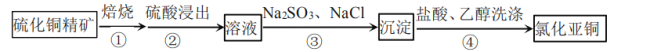题目内容
【题目】现有下列九种物质:①HCl气体 ②Cu ③蔗糖 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氯酸钾溶液 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)属于电解质的是___;属于非电解质的是___。
(2)②和⑧反应的化学方程式为:3Cu +8HNO3=3Cu(NO3)2+2NO↑+4H2O
上述反应中氧化产物是___。硝酸没有全部参加氧化还原反应,参加氧化还原反应的硝酸占总硝酸的___。用双线桥法分析上述反应(只需标出电子得失的方向和数目)___。3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(4)⑨在水中的电离方程式为___,
(5)34.2g⑨溶于水配成1000mL溶液,SO42-的物质的量浓度为___。
【答案】①⑤⑥⑨ ③④ Cu(NO3)2或Cu2+ 25% 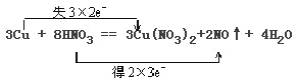 Ba(OH)2+2HNO3=Ba(NO3)2+2H2O Al2(SO4)3=2Al3++3SO42- 0.3mol/L
Ba(OH)2+2HNO3=Ba(NO3)2+2H2O Al2(SO4)3=2Al3++3SO42- 0.3mol/L
【解析】
(1)在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;在水溶液里和熔融状态下都不能导电的化合物是非电解质,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(2)氧化还原反应中所含元素化合价升高的反应物为还原剂,对应产物为氧化产物;依据硝酸中氮元素化合价的变化计算参加氧化还原反应的硝酸占总硝酸的量;根据Cu元素的化合价变化、N元素的化合价变化来分析,化合价升高的元素原子失去电子,化合价降低的元素的原子得到电子,化合价升高值=化合价降低值=转移电子数;
(3)H++OH-═H2O,可以表示强酸与强碱反应生成可溶性盐和水;
(4)硫酸铝为强电解质,水溶液中完全电离;
(5)计算3.42g硫酸铝的物质的量,依据硫酸铝电离方程式计算硫酸根离子的物质的量,依据![]() 计算硫酸根离子的物质的量浓度。
计算硫酸根离子的物质的量浓度。
(1)①HCl气体是在水溶液里能导电的化合物,是电解质;
②Cu是单质,既不是电解质也不是非电解质;
③蔗糖是在水溶液里和熔融状态下都不能导电的化合物,是非电解质;
④CO2本身不能电离,属于非电解质;
⑤H2SO4是在水溶液里能导电的化合物,是电解质;
⑥Ba(OH)2固体是在水溶液里或熔融状态下能够导电的化合物,是电解质;
⑦氯酸钾溶液是混合物,既不是电解质也不是非电解质;
⑧稀硝酸是混合物,既不是电解质也不是非电解质;
⑨熔融Al2(SO4)3是在水溶液里或熔融状态下能导电的化合物,是电解质;
综上所述,属于电解质的是①⑤⑥⑨;属于非电解质的是③④;
故答案为:①⑤⑥⑨;③④;
(2)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,反应中铜元素化合价升高,为还原剂,对应产物硝酸铜为氧化产物,参加反应的硝酸有8mol,只有2mol硝酸中的N化合价降低,作氧化剂,参加氧化还原反应的硝酸占总硝酸的25%;在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e,则用双线桥法标出电子得失的方向和数目为,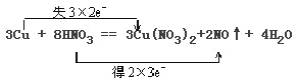 ;
;
故答案为:Cu(NO3)2或Cu2+;25%; ;
;
(3)H++OH═H2O,可以表示稀硝酸与氢氧化钡反应,化学方程式为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(4)硫酸铝为强电解质,完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-;
故答案为:Al2(SO4)3=2Al3++3SO42-;
(5)3.42g硫酸铝的物质的量![]() ,依据硫酸铝电离方程式:Al2(SO4)3=2Al3++3SO42-,可知硫酸根离子的物质的量为0.03mol,则硫酸根离子的物质的量浓度
,依据硫酸铝电离方程式:Al2(SO4)3=2Al3++3SO42-,可知硫酸根离子的物质的量为0.03mol,则硫酸根离子的物质的量浓度![]() ;
;
故答案为:0.3mol/L。

【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
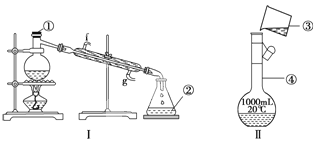
(1)写出下列仪器的名称:①__________,②__________,
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有______________,将仪器补充完整后进行的实验操作的名称为____________;
(3)用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
①应称取Na2CO3·10H2O晶体的质量:__________。
②所用仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还需要__________(填仪器名称)。
③根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
A.Na2CO3·10H2O晶体失去了部分结晶水 |
B.用“左码右物”的称量方法称量晶体(使用游码) |
C.称量碳酸钠晶体时所用砝码生锈 |
D.容量瓶未经干燥使用 |
其中引起所配溶液浓度偏高的有___________(填字母)
④装置Ⅱ是某同学转移溶液的示意图,图中的错误是__________________